COSA CHIEDE L’ONCOLOGO AL CARDIOLOGO
P. Masullo A. Masullo
U.O.C. Oncologia Day Hospital Oncologico
P.O.S. Luca Vallo della Lucania
Nei paesi occidentali i tumori maligni e le malattie cardiovascolari rappresentano le prime due cause di morte.
Il rapporto fra le due patologie è stato da lungo tempo focalizzato sugli aspetti etiopatogenetici comuni rilevati da numerosi studi di epidemiologia clinica che hanno evidenziato fattori di rischio comuni (fumo, sedentarietà, obesità…) e posto le basi per una strategia preventiva singola e con divisa basata sulla rimozione delle cause e sull’interruzione del processo patologico mediante interventi nutrizionali e di farmacoprevenzione.
Negli ultimi anni il rapporto fra le due patologie è diventato ancora più complesso per la cardiotossicità indotta dai farmaci antiblastici registrata sempre più frequentemente sia nelle sperimentazioni cliniche sia nella pratica corrente e rilevata anche a distanza di anni grazie alla lungosopravvivenza di cui godono ormai sempre più pazienti grazie anche all’efficacia della strategia terapeutica adottata.
In Italia e negli USA si contano attualmente e rispettivamente circa 620.000 e 10.000.000 di P
guariti dal cancro avendo praticato chemioterapia, terapie biologiche, radioterapie gravate da tossicità sia acute che a lungo termine anche nei confronti del sistema cardiovascolare.
Lo sviluppo delle terapie adiuvanti coinvolge sempre più P giovani candidati alla guarigione ma esposti al rischio di tossicità a lungo tempo.
La radioterapia rappresenta, inoltre, un altro fattore di rischio cardiovascolare specialmente se associata alla chemioterapia ed erogata sulla parete anteriore toracica in vicinanza dell’area cardiaca. Sono ormai di uso comune nuovi agenti terapeutici diretti verso specifici bersagli delle vie di trasmissione del segnale che regola proliferazione, differenziazione, capacità metastatizzante e morte delle cellule tumorali, processi biomolecolari implicati anche nella regolazione delle normali funzioni delle cellule miocardiche che, se alterati, possono determinare danni anche irreversibili a carico del muscolo cardiaco.
Occorre anche tener presente che l’effetto tossico dei farmaci antiblastici può essere influenzato e amplificato dalle alterazioni strutturali e biochimiche delle cellule miocardiche dovute alla malattia neoplastica.
L a prima evidenza di una cardiotossicità degli agenti a bersaglio molecolare è riportata in uno studio del 2001 sull’uso del trastuzumab nel ca della mammella metastatico. Sono seguite numerose segnalazioni al riguardo in considerazione di:
- I numero dei farmaci antiblastici potenzialmente cardiotossici è in aumento dopo l’avvento delle terapie a bersaglio molecolare
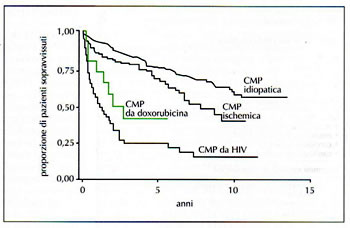
Tab. n. 1

Tab. n. 2

Tab. n. 3

Tab. n. 4

Tab. n. 5
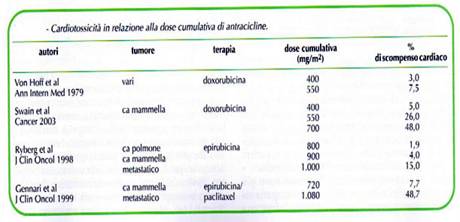
Tab. n. 6
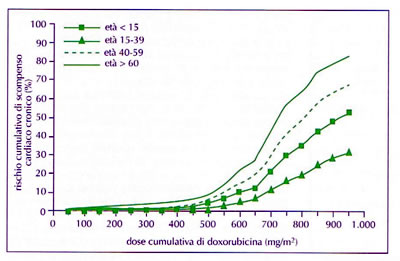
Tab. n. 7
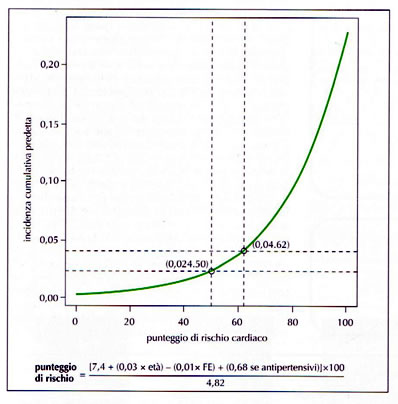
Tab. n. 8
Modello predittivo di incidenza di eventi cardiaci in pazienti chemiotrattati.
- I farmaci cardiotossici per antonomasia sono rappresentati dalle antracicline il cui meccanismo di azione si basa soprattutto sulla formazione di radicali liberi dell’ossigeno
- La cardiotossicità delle antracicline è cumulativa e il rischio di uno scompenso cardiaco aumenta con l’aumentare della dose totale
- Nella pratica clinica è in uso la limitazione empirica della dose totale da erogare.
- Le antracicline liposomiali sono dotate di scarsa cardiotossicità
- Altri farmaci cardiotossici sono: capecitabina, fluorouracile, trastuzumab, ciclofosfamide, paclitaxel, alcaloidi della vinca, ITK, antiangiogenetici, I A.
- Le radiazioni ionizzanti inducono il danno cardiaco essenzialmente attraverso alterazioni pericardiche,miocardiche, valvolari, alterazioni Ec-grafiche.
Tab. n. 9
Tab. n. 10

Tab. 11
Tab. n. 12

Tab. n. 13

Tab. n. 14
La rilevanza clinica della cardiotossicità indotta dai trattamenti antiblastici deve trovare una risposta adeguata nella organizzazione delle strutture e nella organicità del rapporto fra cardiologo e oncologo non occasionale e frammentario ma finalizzato al una gestione comune e condivisa delle problematiche del P nelle varie fasi del percorso terapeutico fino a considerare il cardiologo una componente essenziale del team multidisciplinare che elabora e attua la strategia terapeutica.
Pertanto la collaborazione stretta tra le due figure deve concretizzarsi nell’ approccio precedente l’inizio della terapia antiblastica, nel monitoraggio durante il trattamento, nel follow-up, nella gestione dei P guariti.
Valutazione cardiologia prima della terapia
Indispensabile e finalizzata alla scelta del protocollo. Pertanto deve:
- escludere la presenza di cardiopatie che condizionino o controindichino il trattamento oncologico
- fornire un documento per avviare il successivo monitoraggio
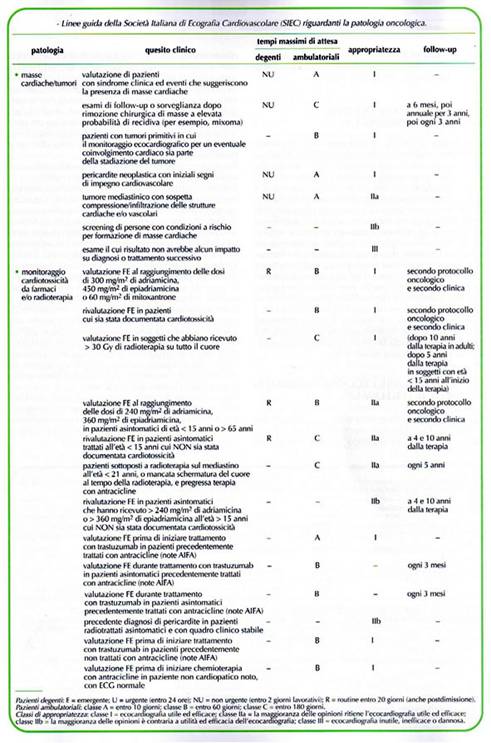
- basarsi su valutazioni cliniche anamnestiche, laboratoristiche, strumentali di enorme utilità per la strategia terapeutica (scelta del protocollo, dosi, tempi e modalità di somministrazione) – (tab. 1)
- raccogliere ed evidenziare i fattori di rischio atti a differenziare il rischio ischemico da quello dello scompenso modulati in base al protocollo prescelto (tabb. 2, 3, 4 e 5)
Nei casi in cui si intenda usare una antraciclina occorre considerare anche i fattori di rischio legati al P:
- E tà: i bambini di età < 4 anni presentano un rischio elevato di cardiotossicità tardiva
- Le donne sono più sensibili alla tossicità (variabile di gender)
- Sono stati identificati polimorfismi genetici predisponesti che rappresentano ormai un dato irrinunciabile nelle sperimentazioni cliniche di fase II e III.
- Utilizzando come variabili età, farmaci antiblastici,FE basale è stata messa a punto una formula per calcolare il rischio cardiotossici (TAB 6, 7 e 8)
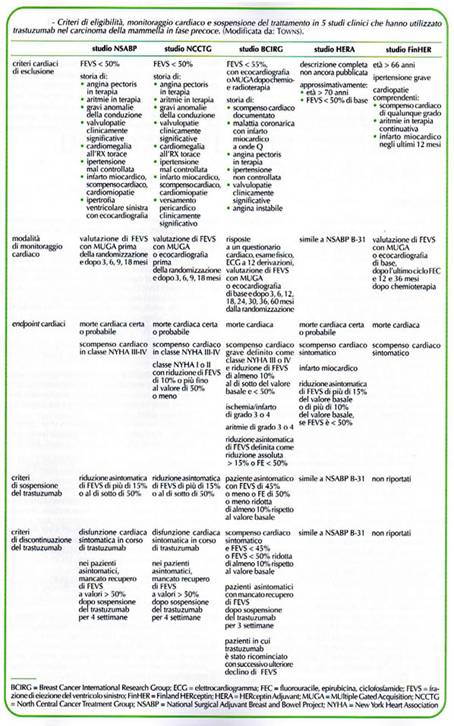
Il momento della visita cardiologia rappresenta un tempo fondamentale della valutazione del P neoplastico in funzione del trattamento, sulla opportunità di intraprenderlo, sulla dose sa somministrare, sul monitoraggio. L a scelta di avviare il trattamento chemioterapico va effettuata valutando il rapporto costo-beneficio, la ricerca clinica ci ha mostrato in cinque studi randomizzati sull’ uso del trastuzumab nel cancro della mammella l’elegibilità, il monitoraggio, la sospensione della terapia (tab. 9)
Monitoraggio cardiologico durante il trattamento antiblastico
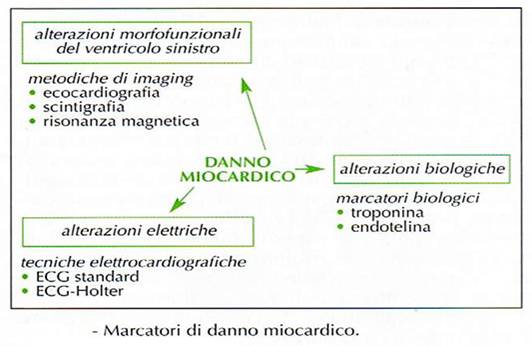
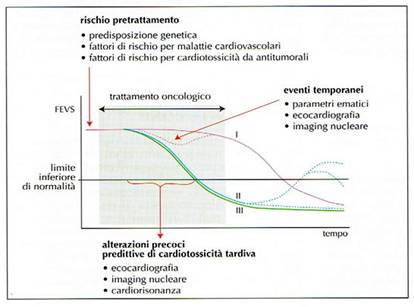
Il riconoscimento precoce del danno miocardio è di fondamentale importanza per attuare una strategia atta a ad evitare il danno irreversibile affrontando vari aspetti: (tab. 13,14 e 15)
- Scelta del marker da utilizzare per definire alterazioni biochimiche, morfofunzionali, elettriche (tab. 16)
- metodica da utilizzare
- cadenza del controllo termine del follow-up
Nella pratica clinica la metodica di uso routinario consiste nel monitoraggio ecocardiografico e nel rilievo e considerazione della F E sviluppando criteri basati su valutazioni effettuate prima e durante la terapia per decidere inizio e prosieguo del trattamento secondo schemi ormai di uso corrente: (tab. 17)
- F E basale = 30%. no al trattamento
- F E basale compreso tra il 30 e 50 %.: rivalutazione prima di ogni ciclo e sospensione se il calo di F E risulta eguale al 10%
Schwatz e coll. hanno evidenziato una riduzione sensibile di scompenso cardiaco se la terapia con antraciclina viene gestita in questo modo ma sollevando l’interrogativo circa l’efficacia della terapia antiblastica .
Pertanto oggi come oggi viene posta all’attenzione dei cardiologi e degli oncologi il quesito sulla appropriatezza della valutazione della F E basale a riposo come unico criterio per valutare gli effetti cardiotossici, per riconoscere il danno precoce e per predire lo sviluppo dello scompenso. (tab. 18)
Prevenzione e terapia del danno miocardio (tab. 10, 11 e 12)
La prevenzione della cardiotossicità dovrebbe costituire un obiettivo primario nella gestione del P da sottoporre a trattamento antiblastico potenzialmente cardiotossici. Sono proponibili varie strategie:
- utilizzo di nuove formulazioni di antracicline liposomiali di pari efficacia e limitata tossicità compatibilmente con le normative di appropriatezza prescrittiva.
- Limitazione del dosaggio totale
- Diversa modalità di somministrazione (as es. : infusione e.v. continua)
- Uso di farmaci cardioprotettori
La formulazione di antracicline incapsulate in liposomi riduce i picchi plasmatici del farmaco perché i liposomi fuoriescono del letto vascolare dove i capillari presentano giunzioni serrate (come a livello miocardio) c he dovrebbe ridurre l’accumulo di doxorubicina; invece dove i capillari sono danneggiati ( come nel tessuto neoplastico) è presente alta concentrazione di farmaco attivo. Per limitarne il picco di concentrazione si può utilizzare l’infusione continua che comunque presenta l’inconveniente di un prolungamento dell’esposizione del P agli effetti tossici.
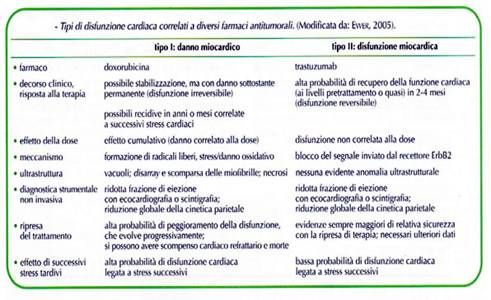
Risulta, pertanto, evidente la necessità di studi molecolari tesi a conoscere e definire meglio i meccanismi dell’azione cardiotossici e a verificare la possibile reversibilità del danno cardiaco che avviene all’atto della sospensione della terapie antiblastica.
I processi di reversibilità fanno supporre la esistenza di diversi meccanismi che determinano la cardiotossicità. da quello irreversibile determinato dalla antraciclina a quello a volte reversibile che si osserva nello scompenso causato da farmaci biologici a da inibitori delle tirosinchinasi.
Tab. n. 15

Tab. n. 16
Tab. n. 17
La terapia della cardiotossicità dovrebbe basarsi sulla rimozione della causa che comporta, di conseguenza, la sospensione del trattamento di contrasto alla crescita di un tumore potenzialmente curabile anche in considerazione del fatto che spesso si associano vari farmaci (polichemioterapia) e non sempre si riesce a stabilire il maggior responsabile della cardiotossicità.
I primo passo del trattamento della cardiotossicità è il confronto tra cardiologo e oncologo teso a definire il rapporto ottimale rischio-beneficio e a sospendere la terapia antiblastica in caso di rischio di vita o nel caso in cui l’effetto tossico superi il beneficio dell’efficacia antitumorale.Un rimedio empirico ma di uso comune è rappresentato dalla sospensione temporanea della terapia antiblastica nell’ipotesi di una reversibilità del danno cardiaco.
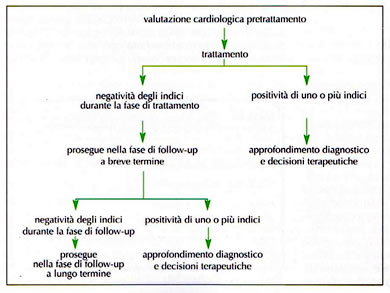
Follow-up a breve e lungo termine
Il follow-up a breve tempo corrisponde convenzionalmente ad un periodo di un anno dal termine della chemioterapia e la cardiotossicità insorta in questo periodo costituisce un fattore predittivo di tossicità tardiva.
La gestione dei P lungosopravviventi rappresenta un nuovo aspetto della pratica clinica in oncologia. la patologia neoplastica tende a diventare sempre più una malattia cronica e la prognosi viene condizionata anche dagli effetti tossici tardivi degli antiblastici.
Tab. n. 18
Considerazioni
La cardiotossicità da chemioterapici, intesa come l’insieme di eventi avversi cardiaci (disfunzione ventricolare sin, scompenso cardiaco, aritmie, ischemia…) provocati da farmaci antitumorali si pone sempre all’attenzione di oncologi, cardiologi e mmg tanto da far nascere una specifica disciplina: la cardiooncologia.
Si distingue in una forma acuta o sub-acuta che può presentarsi durante il trattamento ed in una forma cronica distinta a sua volta in precoce e tardiva a seconda che i disturbi cardiaci si manifestano entro o dopo un anno dalla fine del trattamento.
Le manifestazioni cliniche e strumentali più evidenti vanno dai disturbi della ripolarizzazione all’allungamento del tratto Q-T , alle aritmie , allo scompenso.
Tra i farmaci cardiotossici da più tempo impiegati vanno ricordate le antracicline la cui azione lesiva sul cuore è da ricondurre alla presenza di radicali liberi dell’ossigeno come conseguenza della riduzione enzimatica o della formazione di complessi con il e si presenta nella fase cronica dipendendo dall’accumulo del farmaco.
Recentemente sono entrati nell’uso comune agenti antitumorali target-oriented che agiscono inibendo le chinasi (anticorpi monoclopali, smales molecules che generano una disfunzione cardiaca attraverso una azione lesiva diretta sul miocardio o l’instaurarsi di una ipertensione grave e resistente alla terapia.
In considerazione dell’allungamento della sopravvivenza e dei casi di guarigione oncologica dovuti all’efficacia dei farmaci e alla correttezza della strategia multidisciplinare e con lo scopo di evitare gli effetti tossici cardiovascolari, si cerca sempre più l’individuazione di spie o di marker di precoce cardiotossicità che emergano nel contesto si un programma di chemioprotezione che si traduce nell’adozione di un protocollo operativo di uso comune nei reparti di oncologia. A tal fine presentiamo lo schema adottato nell’U.O. di Oncologia dell’ospedale San Luca di Vallo della Lucania (tab. 19). Che cosa chiede l’oncologo al cardiologo: scoprire precocemente i segni di potenziale cardiotossicità per intraprendere una terapia causale oncologica efficace evitando l’insorgere, come un ineluttabile prezzo da pagare, di una malattia cardiovascolare che può diventare altrettanto invalidante quanto la malattia neoplastica che si intende debellare e di collaborare in un team multidisciplinare che si prefigga lo scopo di CURARE IL CANCRO PROTEGGENDO IL CUORE.

RIFERIMENTI BIBLIOGRAFICI
