Il paziente con stent medicato in trattamento con doppia antiaggregazione in chirurgia non cardiaca
Cesare Baldi, Francesco Vigorito, Tiziana Attisano, Michele Di Muro, Anna Battimelli, Maria Luisa Marra, Pietro Giudice Struttura Complessa di Cardiologia Interventistica-Emodinamica Dipartimento Medico-Chirurgico di Cardiologia A.O.” S. Giovanni di Dio e Ruggi d’Aragona” - SALERNO
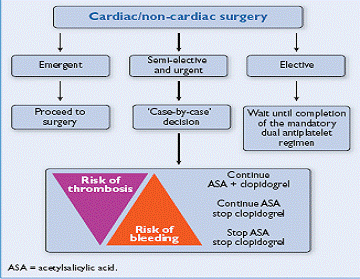
La introduzione nell’armamentario del cardiologo interventista degli stent a rilascio controllato di farmaci antiproliferativi (DES) ha rappresentato una profonda innovazione nel campo della gestione del paziente coronaropatico. I DES hanno infatti ridotto in maniera significativa la restenosi clinica ed angiografica rispetto agli stent metallici convenzionali (BMS); nella fase iniziale del loro impiego, si sono così create le condizioni per una progressiva e quasi incontrollabile euforia a cui ha fatto però seguito il crescente timore di pagare la riduzione della restenosi ad un prezzo troppo alto, sia in relazione alla incidenza crescente della trombosi intrastent (ST) sia per la necessità di vincolare il paziente ad un prolungato ed aggressivo trattamento di doppia antiaggregazione (DAPT). La ST è una complicazione potenzialmente catastrofica dell’uso dei DES; il livello di rischio della ST tende ad aumentare in maniera rilevante in fase perioperatoria e risulta fortemente associato alla sospensione della DAPT. Si calcola che circa il 5% della intera popolazione di pazienti sottoposti a impianto di DES andrà incontro a chirurgia non cardiaca entro il primo anno dalla procedura, ponendo seri problemi di gestione in relazione alla necessità di garantire la continuità del trattamento. Poiché il rischio di ST risulta controllabile solo da parte di una adeguata DAPT, si comprende bene come la comune pratica di sospendere il prescritto trattamento antiaggregante per evitare un eccessivo sanguinamento postoperatorio metta il paziente in una categoria di rischio inaccettabilmente elevato. Le raccomandazioni contenute sia nelle Linee Guida delle società europee che americane prevedono che la DAPT dopo impianto di DES continui per almeno 12 mesi dopo la procedura interventistica (PCI), nei pazienti che non mostrino un elevato profilo di rischio di sanguinamento: pertanto, nei soggetti in attesa di intervento chirurgico, questa prescrizione si apre a numerosi interrogativi di appropriatezza gestionale che ruotano tutti intorno alla complessa relazione che si realizza caso per caso tra tre condizioni: livello di urgenza nella esecuzione dell’intervento chirurgico, rischio trombotico e rischio di sanguinamento nel singolo paziente (fig 1)
Fig.1. Algoritmo per la gestione dei pazienti candidati a chirurgia non cardiaca in trattamento con doppia antiaggregazione (da ESC/EACTS Guidelines on myocardial revascularization 2010)
ü La trombosi intrastent: è motivo di legittima preoccupazione? A dispetto del grande successo iniziale che ha accompagnato i primi anni di uso praticamente senza limiti dei DES, se non quelli imposti dal maggiore onere economico di questi dispositivi, i dati relativi alla incidenza variabile della trombosi tardiva ed ultratardiva hanno rapidamente sollevato non pochi quesiti in termini di sicurezza; un documento consultivo della FDA ha cercato di rispondere a tali inquietanti domande riconoscendo un rischio di ST tardiva associato all’uso dei DES significativamente aumentato, sia pure di dimensioni contenute, rispetto a quello dei BMS, ma, peraltro, precisando che il rischio incrementale appare confinato alla sottopopolazione dei DES ad impiego off label, che copre circa il 60% della totalità dell’uso dei DES. Alcuni punti relativi al fenomeno della ST meritano approfondimento · La ST ha una prognosi infausta, con valori di mortalità oscillanti tra il 9% ed il 45% e con ricorrenza fino al 18% · La finestra temporale in cui può comparire il fenomeno è molto più estesa di quanto si è ritenuto in passato: essa può realizzarsi precocemente (entro 1 mese dall’impianto nella ST subacuta), tardivamente (tra 1 mese ed 1 anno nella ST tardiva) e molto tardivamente (oltre 1 anno nella ST ultratardiva) · Entro 1 anno dall’impianto l’uso dei DES non mostra alcun incremento di incidenza della ST rispetto ai BMS; oltre 1 anno dall’impianto invece, la incidenza di ST ultratardiva appare più frequente nei DES, sebbene contenuta in valori prossimi all’0.6% per anno. · Nonostante l’aumento di incidenza di ST ultratardiva a carico dei DES, questa non si associa ad un parallelo incremento di mortalità cardiaca, fenomeno spiegabile o in relazione alla riduzione degli eventi fatali connessi alla restenosi o perché la mortalità cardiaca a distanza così elevata dall’evento indice può essere spiegata da eventi estranei al segmento originariamente trattato · La genesi del fenomeno ST appare multifattoriale e le diverse variabili coinvolte giocano ruoli differenti nelle diverse forme temporali della ST: nella ST precoce la responsabilità del fenomeno va attribuita o a errori procedurali nell’impianto stent (dissezione residua, espansione inadeguata con malapposizione dello stent alle pareti del vaso) oppure a deficit di attività inibitoria della aggregazione piastrinica da parte dei farmaci (scarsa compliance del paziente, resistenza al farmaco); nella ST tardiva ed ultratardiva i meccanismi fisiopatologici sembrano chiamare in causa piuttosto fenomeni di reazione infiammatoria cronica o di ipersensibilità che insieme alla adozione di particolari tecniche di trattamento di lesioni su TC o su biforcazione o di occlusione cronica totale possono spiegare il meccanismo di ritardata ed incompleta neo-endotelizzazione degli strut dello stent che li rende vulnerabili alla aggressione delle piastrine attivate ed alla successiva deposizione di fibrina.
ü Quando, come e perché la fase perioperatoria risulta pericolosa per il paziente portatore di DES in DAPT candidato a chirurgia non cardiaca? La ST è un processo strettamente connesso al diretto intervento delle piastrine; peraltro, nei DES il processo di riendotelizzazione può durare al di là del tempo previsto: non stupisce quindi che il predittore più potente di ST è la interruzione precoce della DAPT. I pazienti sottoposti a chirurgia non cardiaca mostrano mediamente un incremento significativo della mortalità se l’intervento viene effettuato entro le sei settimane dall’intervento rispetto ai pazienti operati dopo le sei settimane. Una serie di 36 casi di ST tardiva in pazienti con DES ha però mostrato una forte associazione tra gli eventi clinici avversi e la sospensione della DAPT, con valori medi dell’intervallo compreso tra l’impianto del DES e la comparsa dell’evento avverso pari a 242 giorni (range 39-927 gg). Inoltre il 55% dei pazienti aveva interrotto la assunzione sia di ASA che di clopidogrel, mentre l’86.3% dei pazienti aveva interrotto il solo clopidogrel secondo le prescrizioni ufficiali che prevedono la sospensione dopo 3 mesi per i DES a rilascio di sirolimus e dopo 6 mesi per quelli a rilascio di paclitaxel. Il tempo medio di comparsa di un evento avverso risultò 30 giorni per la sospensione del solo clopidogrel e 7 giorni per la sospensione combinata di ASA e clopidogrel. In altre parole, se la chirurgia effettuata precocemente dopo impianto DES si associa ad un incremento inaccettabile di mortalità perioperatoria, anche per i pazienti che abbiano completato il prescritto periodo di 12 mesi di DAPT il rischio non si annulla, tanto che, nei casi di impiego off label, la DAPT viene prolungata fino a 24 mesi e, in taluni casi selezionati, mantenuta indefinitamente. Il clinico viene chiamato in tale contesto a mantenere un difficile equilibrio tra la sospensione anticipata del trattamento antiaggregante, che può provocare un evento perioperatorio di ST, e la decisione di non interrompere la DAPT, responsabile dell’ incremento del rischio di sanguinamento chirurgico che può risultare potenzialmente fatale. I dati disponibili sembrano indicare che il rischio di interruzione del trattamento si associa ad una incidenza di morte cardiaca perioperatoria di almeno 5-10 volte superiore al rischio di mantenere immodificato il trattamento. L’intervento chirurgico come tale realizza una condizione protrombotica e pro infiammatoria che facilita lo sviluppo di ST perioperatoria. Lo stress chirurgico promuove una stimolazione adrenergica ed il rilascio di citochine della fase infiammatoria che condizionano sinergicamente un incremento della vasomotricità coronarica e della attivazione piastrinica connesso ad un indebolimento del sistema fibrinolitico: questo contesto di ipercoagulabilità sembra addirittura superare quello che si viene a creare nelle sindromi coronariche acute. D’altra parte la sospensione improvvisa del trattamento antiaggregante induce un pericoloso fenomeno di “rimbalzo” delle attività funzionali piastriniche finora soppresse e che esplodono rapidamente tutto il loro potenziale pro trombotico. La combinazione di questi due fenomeni, le modifiche indotte dallo stress chirurgico e le conseguenze della risposta in rimbalzo alla sospensione della DAPT, fanno comprendere quanto sia potenzialmente catastrofico l’atteggiamento non infrequente di quei chirurghi che, per minimizzare il sanguinamento intraoperatorio, non esitano a sospendere il trattamento antiaggregante senza considerare i rischi connessi nel singolo paziente, in particolare se portatore di DES ad impianto recente.
ü Impatto della DAPT sul rischio di sanguinamento La previsione del rischio incrementale di sanguinamento e di impiego di trasfusioni in pazienti sottoposti a chirurgia maggiore non cardiaca è stata largamente derivata dalla letteratura cardiochirurgica che contiene dati controversi. Sicuramente i pazienti in DAPT che vengono sottoposti a chirurgia coronarica presentano una maggiore incidenza di sanguinamento, di revisione e di trasfusione, in particolare quelli che affrontano l’intervento a meno di 5 gg dalla sospensione del clopidogrel; ma anche in questi l’aumento del rischio di queste complicanze perioperatorie non sembra mai tradursi in un significativo aumento di mortalità. I dati provenienti dalle analisi condotte in chirurgia non cardiaca appaiono più limitati e controversi. Nella metanalisi di Burger, che ha incluso oltre 40000 pazienti sottoposti a chirurgia non cardiaca, continuare l’ASA ha generato un rischio incrementale di sanguinamento del 50%, senza però aumentare la incidenza dei sanguinamenti severi né dei sanguinamenti fatali con eccezione della chirurgia intracranica, della chirurgia del canale spinale e della prostatectomia trans uretrale (ma aumentando significativamente la incidenza degli eventi cerebro-cardio-vascolari). I dati di numerosi studi sembrano convergere sulla evidenza che, pur in presenza di un sicuro incremento del sanguinamento chirurgico, il trattamento antiaggregante non risulta associato a modifiche significative in termini di esiti sfavorevoli a distanza dell’intervento chirurgico e di mortalità. In conclusione, il rischio connesso alla sospensione della DAPT in pazienti con DES potrebbe avere un peso decisamente maggiore del rischio di mantenerla immodificata, in particolare nei pazienti ad alto rischio di ST, e la pratica sfortunatamente comune di interrompere i farmaci in fase preoperatoria andrebbe scoraggiata pur in una gestione caso per caso del paziente individuale.
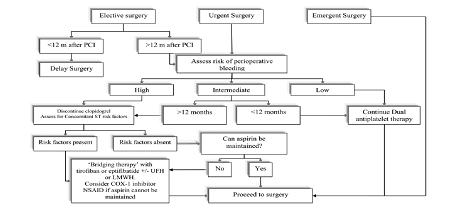
ü Strategie di gestione perioperatoria del paziente con DES in DAPT In relazione alla mancanza di studi prospettici che abbiano affrontato questo specifico argomento, l’approccio alla gestione del paziente portatore di DES e candidato a chirurgia non cardiaca dovrebbe essere condotto su base individuale, ispirarsi ad una visione multidisciplinare che coinvolga il cardiologo, il chirurgo e l’anestesista ed infine considerare costantemente il rapporto tra rischio trombotico e rischio emorragico. Gli interventi chirurgici in elezione dovrebbero essere differiti almeno 6 mesi, ma, meglio ancora, 12 mesi dopo l’impianto del DES; in epoca anteriore ai 6 mesi, qualora l’intervento non possa essere differito per una condizione di urgenza, è della massima importanza mantenere la DAPT per ridurre il rischio di ST: questa condotta può essere seguita nella maggioranza degli interventi chirurgici ad eccezione di quelli effettuati in aree anatomiche caratterizzate da uno spazio chiuso in cui il sanguinamento potrebbe avere conseguenze catastrofiche, come per la chirurgia intracranica, del canale spinale, della camera posteriore dell’occhio e per la resezione transuretrale della prostata. Per gli interventi da affrontare a distanza di oltre 12 mesi dall’impianto il rischio di ST, pur nettamente inferiore a quello della chirurgia più precoce, non può essere considerato assolutamente marginale e trascurabile; pertanto, se il rischio emorragico appare contenuto, è preferibile continuare la DAPT; se invece tale rischio appare più consistente e non sussistono fattori di rischio per una ST ultratardiva, sembra ragionevole sospendere esclusivamente la tienopiridina e mantenere l’aspirina. Negli interventi associati ad un elevato rischio di sanguinamento perioperatorio per problemi connessi al tipo di chirurgia o al tipo di paziente, la tienopiridina può essere sospesa 5 gg prima, mantenendo l’aspirina; ma, in relazione alla alta incidenza di ST nei primi giorni subito dopo l’intervento, è necessario ricominciare la assunzione di clopidogrel appena possibile e con dose di carico di 600 mg. Nel caso di ricorso precoce alla chirurgia in una finestra temporale ancora particolarmente critica per la incidenza di eventi e nel caso in cui sussistano uno o più fattori di rischio per ST (diabete mellito, insufficienza renale cronica, recente SCA, trattamento di TC, di biforcazione, di lesione lunga, impiego di DES multipli) bisogna prendere in considerazione una terapia di transizione (“bridging therapy”). Allo stato attuale gli antitrombotici del tipo eparina non frazionata o eparina a basso peso molecolare, largamente utilizzati in clinica per sostituire la TAO in fase perioperatoria, ed intituivamente proposti anche in questo contesto clinico, non hanno mostrato alcuna efficacia nella prevenzione della ST in pazienti con DES perché non mostrano alcuna attività nei confronti delle piastrine che risultano direttamente coinvolte nel fenomeno alla base della ST. Una categoria di farmaci particolarmente interessante per le prospettive di impiego in questo particolare contesto clinico è invece rappresentata dagli inibitori del recettore GP IIb/IIIa; tra questi, con esclusione dell’abcximab che mostra un legame irreversibile con il recettore ed un tempo di azione non utilmente prolungato, le piccole molecole, tirofiban ed eptifibatide, mostrano una breve emivita dovuta ad un legame reversibile con il recettore, il che consente un completo recupero della funzione piastrinica entro le 2-4 ore successive alla sospensione della infusione del farmaco. Un recente studio prospettico di bridging therapy, condotto con l’impiego di un inibitore anti GP IIb/IIIa a breve durata d’azione in 30 pazienti con impianto recente di DES (< 4 mesi) e sottoposti d’urgenza a chirurgia maggiore, non ha mostrato alcun evento fatale, né di ST né di infarto miocardico, in presenza di due soli sanguinamenti postoperatori, uno maggiore ed uno minore gestiti in maniera conservativa. In conclusione, se il rischio di sanguinamento perioperatorio appare accettabile è importante mantenere la DAPT. Se, invece, il rischio emorragico è rilevante e non sussistono concomitanti fattori di rischio per ST può essere ragionevole sospendere la tienopiridina mantenendo l’aspirina. Nei pazienti che presentano simultaneamente fattori di rischio multipli per ST e un elevato rischio emorragico va presa in considerazione la “bridging therapy” (fig 2).
Fig 2. Algoritmo per la gestione perioperatoria dei pazienti con DES (da voce n°5)
BIBLIOGRAFIA ESSENZIALE
1. King SB III, Smith SC Jr., Hirshfeld JW Jr., et al. 2007 focused update of the ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2008;51:172–209. 2. Grines CL, Bonow RO, Casey DE Jr., et al. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: a science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Coll Cardiol 2007;49:734 –9. 3. 2009 ACCF/AHA Focused Update on perioperative beta blockade incorporated into the ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for Noncardiac Surgery J Am Coll Cardiol 2009;54;e13-e118 4. Guidelines on myocardial revascularization The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Eur Heart J doi:10.1093/eurheartj/ehq277 5. Ali O. Abualsaud, Mark J. Eisenberg. Perioperative management of patients with Drug-Eluting Stents. J Am Coll Cardiol Intv 2010;3:131–4
7. Iakovou I, Schmidt T, Bonizzoni E, et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005;293:2126 –30 8. Eisenberg MJ, Richard PR, Libersan D, et al. Safety of short-term discontinuation of antiplatelet therapy in patients with drug-eluting stents. Circulation 2009;119:1634–42. 9. Kaluza GL, Joseph J, Lee JR, et al. Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000;35:1288 –94. 10. Schouten O, Bax JJ, Damen J, et al. Coronary artery stent placement immediately before noncardiac surgery: a potential risk? Anesthesiology 2007;106:1067–9.
|