L’
ALCOOLIZZAZIONE DEL SETTO
NELLA MIOCARDIOPATIA IPERTROFICA
Maurizio
Menichelli
Unità Operativa di Cardiologia Interventistica
Azienda Ospedaliera San Camillo – Forlanini, Roma
La Cardiomiopatia Ipertrofica (HCM)
La HCM è fondamentalmente una malattia genetica del muscolo
cardiaco (miocardio). La caratteristica più costante
della cardiomiopatia ipertrofica è un marcato aumento
dello spessore della parete del cuore. Le conseguenze della
Cardiomiopatia Ipertrofica nei pazienti sono legate, in parte
o esclusivamente, a questo aumento di spessore del muscolo cardiaco,
che a sua volta è la conseguenza di un difetto genetico
di base. L’ipertrofia può coinvolgere l’intero
ventricolo sinistro, sebbene non sempre, e non vi è nessuna
localizzazione tipica dell’aumento di spessore. Nella
Cardiomiopatia Ipertrofica, l’ipertrofia è definita
"primaria", ovvero non è la conseguenza di
un’altra malattia, ma è invece dovuta ad un difetto
genetico, al microscopio, il muscolo cardiaco nella solitamente
mostra alcune anormalità particolari, la più evidente
delle quali viene chiamata disorganizzazione (disarray) delle
cellule muscolari cardiache (miociti) in cui il normale allineamento
parallelo delle cellule è andato perduto e molte delle
cellule muscolari sono disposte in modo caratteristicamente
caotico e disorganizzato. È probabile che questa disorganizzazione
delle cellule interferisca con la normale trasmissione elettrica
degli impulsi e predisponga alcuni pazienti a irregolarità
del ritmo cardiaco o anche a una alterata contrazione del cuore.
Studi recenti condotti negli Stati Uniti suggeriscono che la
Cardiomiopatia Ipertrofica (HCM) è una malattia più
frequente di quanto non si credesse. Si stima che, attualmente,
nella popolazione generale 1 individuo su 500 o 1 su 1000 sia
affetto da HCM. Queste stime sono relative a soggetti adulti
nei quali la Cardiomiopatia Ipertrofica è diagnosticabile
con l’ecocardiografia. Bambini o individui adulti possono
però anche essere portatori del gene mutante per la Cardiomiopatia
Ipertrofica senza manifestare i segni clinici della malattia
(l’ipertrofia). Nella letteratura medica, la Cardiomiopatia
Ipertrofica è stata riportata come più frequente
negli uomini che nelle donne (circa 60% rispetto al 40%). In
realtà, dato che la Cardiomiopatia Ipertrofica è
una malattia genetica trasmessa con meccanismo di tipo autosomico
dominante, è presente in uguale misura negli uomini e
nelle donne. Questo indica che la Cardiomiopatia Ipertrofica
è diagnosticata meno frequentemente nelle donne rispetto
agli uomini. Le ragioni di tale fenomeno sono incerte. Tuttavia,
vi è ora una qualche evidenza che le donne con Cardiomiopatia
Ipertrofica sviluppino sintomi e vengano diagnosticate più
tardi, e possono avere conseguenze più gravi della loro
malattia rispetto agli uomini. La modalità con cui la
Cardiomiopatia Ipertrofica si trasmette si definisce autosomica
dominante. Questo significa che vi è il 50% delle probabilità,
a ogni gravidanza, che la malattia (e il gene mutante) venga
trasmessa al nascituro. Quindi, la probabilità che un
soggetto affetto trasmetta ai figli l’alterazione genetica
è statisticamente stimata 1 su 2. In ogni caso, la trasmissione
autosomica dominante non implica necessariamente che, se un
individuo ha 4 figli, due di essi saranno sicuramente malati;
questa è soltanto una probabilità statistica.
Di fatto potrebbero essere tutti sani o all’opposto 4
su 4 malati. Alcuni individui con la Cardiomiopatia Ipertrofica
vengono classificati come casi "sporadici", ovvero,
nessuno dei loro familiari risulta essere affetto dalla malattia.
L’assenza della malattia in una generazione ("genetic
skipping") è rara e si verifica quando un individuo
che è portatore dell’alterazione genetica non mostra
segni della malattia all’ecocardiogramma. In tali circostanze,
il gene mutante di fatto non "salta" una generazione
- in realtà il gene della Cardiomiopatia Ipertrofica
in quell’individuo semplicemente non viene espresso in
modo completo, cioè nel modo in cui la malattia è
dimostrabile attraverso un esame ecocardiografico Sono state
descritte più di 140 mutazioni in 10 geni che codificano
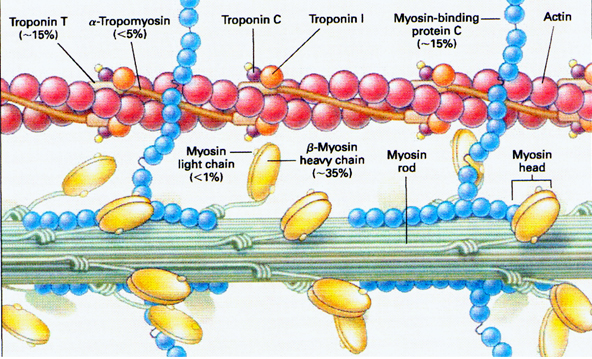
per proteine implicate nella contrazione cardiaca. Il gene più
frequentemente coinvolto sembra essere MYH7 che codifica per
la catena pesante della beta-miosina cardiaca. (Fig 1)
TABELLA
I

Ablazione
alcolica del setto nella cardiomiopatia ipertrofica
Da alcuni anni, come alternativa all’intervento chirurgico,
è stata proposta una tecnica di ablazione percutanea
del setto interventricolare mediante iniezione selettiva di
alcuni ml di alcool in un ramo settale dell’arteria interventricolare
anteriore . L’indicazione a questa tecnica terapeutica
della cardiomiopatia ipertrofica sono : ( fig2 )
1. Sintomi in classe NYHA III o IV in nonostante il trattamento
farmacologico
2. Un gradiente interventricolare di base di almeno 50 mmHG
(Fig 2)
Figura
1
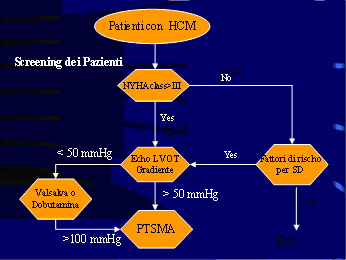
Figura 2
Tecnicamente
la procedura non presenta particolari difficoltà in mani
esperte.
Viene posizionato un catetere guida per angioplastica coronarica
nell’ostio della coronaria sinistra, un altro catetere
viene avanzato all’apice del ventricolo sinistro, ed un
catetere stimolatore provvisorio viene inserito nel ventricolo
destro. Si monitorizzano in contemporanea le curve di pressione
in ventricolo sinistro e in aorta per valutare il gradiente
intraventricolare. Il ramo settale che sembra irrorare il territorio
del setto basale viene selettivato con un filo guida da angioplastica
coronarica e con un catetere a palloncino tipo over-the-wire
di diametro lievemente superiore a quello del ramo settale.
Il gonfiaggio del palloncino nel ramo settale permette una iniezione
selettiva di farmaci, mezzo di contrasto o alcool, evitandone
il reflusso nell’arteria interventricolare anteriore.
( FIG 3)
Figura
3
L’alcool
determina immediata necrosi miocardica nel territorio perfuso
dal ramo settale iniettato. La perdita della funzione contrattile
della porzione basale del setto causa una abolizione del contatto
tra valvola mitrale e setto in sistole ed una conseguente una
riduzione od abolizione del gradiente. La sostituzione del miocardio
necrotico con tessuto cicatriziale e successivi fenomeni di
rimodellamento possono determinare un progressivo assottigliamento
del setto ed ulteriore riduzione del gradiente durante il follow-up.
Il punto cruciale della tecnica è la scelta del ramo
settale in cui iniettare l’alcool. Nelle prime esperienze,
il ramo settale veniva scelto unicamente su base angiografica,
ovvero sulla base delle sue dimensioni e della sua localizzazione
anatomica.In alternativa, la scelta si basava sulla valutazione
dell’effetto dell’iniezione selettiva di farmaci
isotropi negativi o dell’ischemia causata dal prolungato
gonfiaggio del palloncino.
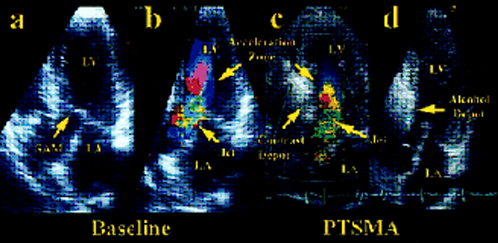
La valutazione ecocontrastografica del territorio di distribuzione
del ramo - o dei rami - settali come mezzo per la scelta della
sede di iniezione dell’alcool ha rappresentato un notevole
passo avanti nell’accuratezza e nella sicurezza della
procedura. Secondo questa tecnica, attraverso il lume del palloncino
si inietta nel ramo settale mezzo di contrasto per ecocardiografia
(Levovist, Schering, 350 mg/ml o Albunex, Mallinckrodt, diluizione
50%) e si visualizzano, con ecocardiogramma transtoracico, le
strutture miocardiche irrorate dal ramo settale. Se il mezzo
di contrasto si distribuisce esclusivamente sul setto basale,
nel punto di contatto sistolico con i lembi mitralici, in corrispondenza
della massima accelerazione del flusso valutata al color-Doppler
(Figura 4)
La successiva iniezione di alcool provoca una necrosi selettiva
dell’area miocardica responsabile della genesi dell’ostruzione
all’efflusso. Quando l’ecocontrasto dimostra invece
un territorio di perfusione del ramo settale che coinvolge altre
strutture miocardiche, quali il muscolo papillare o la parete
libera del ventricolo sinistro, è necessario cercare
di selettivare un altro settale o una sua diramazione secondaria
con esclusiva distribuzione nella zona bersaglio
Figura
4
Talvolta
questo non è possibile; in altri casi, il territorio
irrorato, seppur limitato al setto basale, ha una estensione
troppo modesta e la successiva ablazione non provoca una sufficiente
riduzione dell’ostruzione.
Vari registri clinici su i pazienti trattati con questa tecnica
( circa 1500 pazienti ) hanno dimostrato che l’alcolizzazione
del setto nella cardiomiopatia ipertrofica e’ una tecnica
a rischio basso , che l’incidenza dell’impianto
di un PMK definitivo si è ridotta a circa il 7 % dopo
l’introduzione dell’uso dell’ecocontrasto
e che le temute complicanze aritmiche e di rimodellamento ventricolare
sinistro sono particolarmente rare.
Va comunque ricordato che attualmente non abbiamo dati clinici
che fanno presupporre che questa tecnica sia in grado di migliorare
la sopravvivenza di questi malati. . Il suo utilizzo viene quindi
riservato unicamente al fine di migliorare la qualità
di vita di questi pazienti
L’ablazione alcolica del setto nella cardiomiopatia ipertrofica
è quindi da considerare un nuovo presidio terapeutico
meno invasivo miectomia chirurgica per una malattia spesso invalidante
.
Va comunque ricordato che questa tecnica non è scevra
di complicanze e deve essere riservata solo a coloro che siano
particolarmente sintomatici nonostante una adeguata terapia
medica





