LE
TERAPIA DELLE SINDROMI CORONARICHE ACUTE
CON ELEVAZIONE DEL TRATTO ST :
DALLE LINEE GUIDA ALLA PRATICA CLINICA
Ciro
Indolfi, Annalisa Mongiardo, Carmen Spaccarotella,
Alessandro Ferraro, Daniele Torella
U.O. di Cardiologia Interventistica, Cattedra di Cardiologia
& Centro Regionale di Riferimento per il trattamento endovascolare
delle patologie cardiovascolari – Università “Magna
Græcia”, Catanzaro.
Introduzione
L’infarto miocardico acuto con sopraslivellamento del
tratto ST, secondo tutte le linee guida, dovrebbe essere trattato
(quando è disponibile un laboratorio di emodinamica adeguatamente
attrezzato e dotato di un team esperto) mediante angioplastica
primaria. Questa, inizialmente introdotta come alternativa alla
terapia fibrinolitica è ormai considerata come la terapia
riperfusiva di scelta. Quasi due decadi dopo che i trials clinici
hanno dimostrato che la terapia fibrinolitica per l’infarto
miocardico acuto preserva la funzione ventricolare sinistra
e riduce la mortalità, oggi esistono evidenze che la
terapia meccanica di riperfusione è superiore a quella
farmacologica in termini di riduzione della percentuale di mortalità,
reinfarto, sanguinamento intracranico, riocclusione dell'arteria
responsabile dell’infarto e di ischemia ricorrente. È
ormai noto che la possibilità di ridurre la mortalità
per infarto miocardico acuto (IMA) è strettamente legata
al ripristino di un flusso efficace nel vaso responsabile (TIMI
III). Infatti esiste una relazione pressoché lineare
tra pervietà del vaso responsabile dell’IMA 90’
dopo l’inizio della terapia riperfusiva e mortalità
intraospedaliera1. Tale obiettivo terapeutico è raggiungibile
mediante angioplastica coronarica (PTCA) in oltre il 95% dei
pazienti, cioè in una percentuale di gran lunga superiore
a quella ottenibile con i trattamenti fibrinolitici.
LA
METANALISI DEGLI STUDI CHE HANNO CONFRONTATO LA PTCA VERSUS
LA TROMBOLISI NELL’IMA.
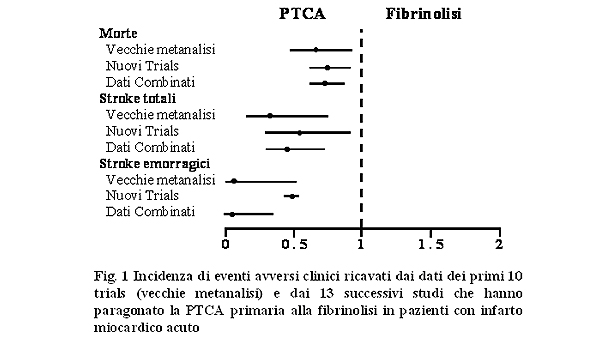
Recentemente è stata pubblicata su Lancet (Figura 1)
la metanalisi di Keeley e coll.2 relativa a 23 trials in cui
sono stati arruolati in totale 7739 pazienti con infarto miocardico
acuto randomizzati ad angioplastica primaria o fibrinolisi.
Di questi, solo in 8 trials era stata usata la streptochinasi,
mentre la maggior parte dei pazienti (76%) randomizzati alla
fibrinolisi erano stati trattati con r-TPA. I risultati di questa
metanalisi indicano che la PTCA primaria è più
efficace della terapia fibrinolitica riducendo l’incidenza
di eventi avversi cardiaci maggiori.
La percentuale di decessi è significativamente più
bassa nel gruppo dei pazienti trattati con PTCA primaria rispetto
a quelli sottoposti a terapia fibrinolitica (7% vs 9%; p=0.0002)
e tale differenza tra i due gruppi si mantiene costante anche
se si escludono dall’analisi i pazienti arruolati nello
SHOCK Trial3 (uno studio in cui sono stati arruolati pazienti
ad alto rischio, con shock cardiogeno). Infatti, la percentuale
di decessi è rispettivamente 5% nel gruppo PTCA versus
7% in quello trattato con terapia medica.
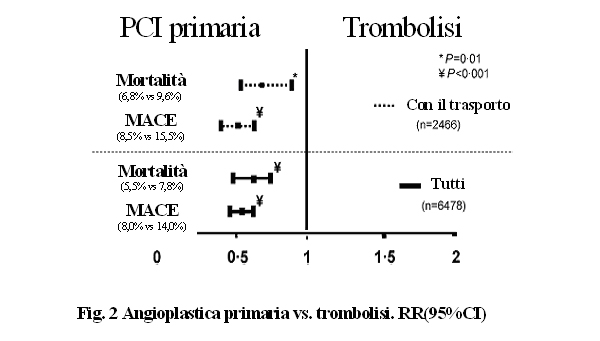
Inoltre,
anche quando la terapia riperfusiva è stata ritardata
a causa della necessità di trasferire il paziente in
un altro ospedale dotato di un laboratorio di emodinamica, i
risultati, in termini di eventi avversi cardiaci maggiori, sono
stati migliori (figura 2) rispetto a quelli ottenuti con la
trombolisi4.
Ovviamente il beneficio non è costante per tutti i pazienti,
ma progressivamente maggiore in misura proporzionale al rischio
del paziente. Le maggiori riduzioni di mortalità, infatti,
si ottengono nei pazienti ad alto rischio, con grave disfunzione
ventricolare sinistra e/o età avanzata.
La maggiore efficacia della ricanalizzazione meccanica rispetto
a quella farmacologica non si è però tradotta
nella sua diffusione sistematica in tutti i pazienti con IMA.
Anche negli Stati Uniti, la maggior parte degli ospedali non
ha la possibilità di effettuare l’angioplastica
primaria e in molti di questi quasi il 50% dei pazienti con
infarto miocardico acuto ed ST sopraslivellato vengono sottoposti
a terapia fibrinolitica.
L’uso
più parsimonioso dell’angioplastica primaria (circa
l’11% di tutti gli infarti acuti) sembrerebbe negare la
superiorità di questa metodica rispetto alla fibrinolisi.
In realtà, i motivi della sua limitata diffusione a distanza
di oltre 15 anni dalla prima angioplastica primaria sono molteplici:
di ordine economico, culturale, ma soprattutto organizzativi.
Il motivo principale è riferibile al fatto che la superiore
efficacia della ricanalizzazione meccanica è evidente
soltanto quando vengono soddisfatti degli standards operativi
difficili da raggiungere nella corrente organizzazione sanitaria
(centro ad elevato volume e operatore esperto). Quando una strategia
di angioplastica primaria è stata provata nel “mondo
reale”, e cioè al di sotto di standards operativi
minimi, i risultati sono stati di gran lunga inferiori a quelli
dimostrati da altri trials di confronto tra fibrinolisi e angioplastica
primaria.
Ovviamente l’obiettivo primario della terapia riperfusiva
nell’infarto miocardico acuto è la ricanalizzazione
precoce e persistente dell’arteria infartuale:
-precoce perché l’effetto clinico della terapia
riperfusiva va progressivamente riducendosi con il passare delle
ore, sia per la fibrinolisi che, in misura minore, anche per
l’angioplastica primaria; -persistente perché la
riocclusione dell’arteria infartuale, che si verifica
nel 10% dei casi circa entro 1 settimana, è gravata da
una prognosi sfavorevole.Tale obiettivo terapeutico è
oggi raggiungibile in un’elevata percentuale dei casi
mediante l’utilizzo alternativo o combinato di strategie
farmacologiche e meccaniche. Non vi è dubbio che, laddove
eseguibile in tempi brevi, e possibilmente da parte di operatori
esperti, l’angioplastica primaria rappresenti la strategia
riperfusiva ottimale, soprattutto se associata allo stenting
e all’impiego di antagonisti della glicoproteina (GP)
IIb/IIIa piastrinica5: la PCI è in grado di ricanalizzare
l’arteria responsabile dell’IMA in oltre il 90%
dei casi e mantiene un’elevatissima percentuale di pervietà
a distanza.
LE
LINEE GUIDA
Le linee guida ACC/AHA consigliano di dividere il periodo del
post-infarto in tre momenti successivi e distinti, non necessariamente
simili per tutti i pazienti. La suddivisione è, infatti,
arbitraria per la difficoltà di individuare un comune
punto di partenza in tutti i pazienti. Sono stati inclusi nel
gruppo dei pazienti con ST sopraslivellato anche i pazienti
con dolore toracico tipico e nuova, o presunta tale, insorgenza
di blocco di branca sinistra all’ECG che maschera la diagnosi
di IMA.
Nel primo periodo, quando il paziente è ancora in terapia
intensiva, se presenta sopraslivellamento del tratto ST o blocco
di branca di nuova insorgenza, la coronarografia è indicata
come preludio alla PTCA primaria in alternativa alla trombolisi.
Il secondo periodo è relativo al trasferimento del paziente
nel reparto di cardiologia. Durante questa fase la necessità
del ricorso alla coronarografia è determinata dallo sviluppo
di alcune complicazioni dell’infarto, come angina post-infartuale,
scompenso cardiaco successivi a difetti interventricolari (DIV),
disfunzione di muscolo papillare o persistenza di aritmie maligne
entro le prime 24 ore dall’infarto. L’ultimo periodo
dall’infarto, durante il quale la coronarografia potrebbe
essere utile è al momento della dimissione per la stratificazione
del rischio o in presenza di stress test positivo. La ricanalizzazione
dell’arteria responsabile dell’infarto ed il ripristino
di un flusso adeguato in una larga maggioranza di pazienti determina
un miglior recupero funzionale del miocardio.
In uno studio prospettico osservazionale del National Registry
of Myocardial Infarction l’analisi dei risultati di una
coorte di 27080 pazienti consecutivi con IMA che sono stati
trattati con PTCA primaria in 661 ospedali di I e di III livello
negli Stati Uniti, ha dimostrato una forte correlazione tra
l’incremento della mortalità e l’allungamento
del tempo intercorrente tra l’ingresso del paziente in
ospedale e l’inizio della procedura interventistica (“door-to-balloon
time”) superiore a 2 ore. Dunque, il “door-to-balloon
time” può essere considerato un valido indicatore
della qualità del trattamento, e dovrebbe essere ridotto
quanto più è possibile al fine di ottenere migliori
risultati clinici. Una strategia di trasferimento
per tutti i pazienti con IMA, in centri dotati di cardiologia
interventistica è stata valutata recentemente negli studi
DANAMI 2 e PRAGUE 2.
Le linee guida dell’ACC/AHA e della Società Europea
di Cardiologia forniscono raccomandazioni circa l’uso
appropriato di un programma di PTCA primaria, e scoraggiano
fermamente i piani che prevedono uno scarso numero di procedure.
L’impatto di queste specifiche linee guida nella pratica
clinica è più basso di quanto desiderato. Solo
gli ospedali che posseggono un laboratorio di emodinamica adeguato
possono considerare la PTCA primaria come terapia di routine
nell’IMA12.
Tabella 2.17. Linee Guida AHA/ACC (2001) per la PCI primaria
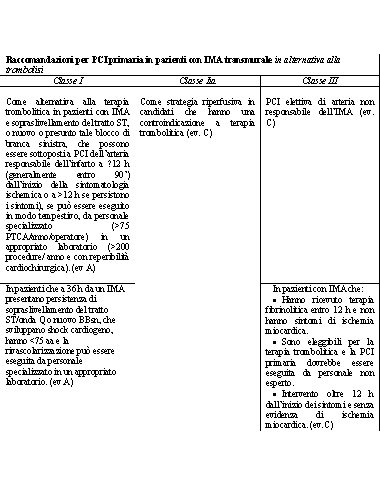
Raccomandazioni per PCI primaria in pazienti con IMA transmurale
in alternativa alla trombolisi
Classe I Classe Iia Classe III
Come
alternativa alla terapia trombolitica in pazienti con IMA e
sopraslivellamento del tratto ST, o nuovo o presunto tale blocco
di branca sinistra, che possono essere sottoposti a PCI dell’arteria
responsabile dell’infarto a =12 h (generalmente entro
90’) dall’inizio della sintomatologia ischemica
o a >12 h se persistono i sintomi), se può essere
eseguito in modo tempestivo, da personale specializzato (>75
PTCA/anno/operatore) in un appropriato laboratorio (>200
procedure/ anno e con reperibilità cardiochirurgica).
(ev A)
Come strategia riperfusiva in candidati che hanno una controindicazione
a terapia trombolitica (ev. C)
PCI elettiva di arteria non responsabile dell’IMA (ev.
C)
In pazienti che a 36 h da un IMA presentano persistenza di sopraslivellamento
del tratto ST/onda Q o nuovo BBsn, che sviluppano shock cardiogeno,
hanno <75 aa e la rivascolarizzazione può essere eseguita
da personale specializzato in un appropriato laboratorio. (ev
A)
In pazienti con IMA che:
• Hanno ricevuto terapia fibrinolitica entro 12 h e non
hanno sintomi di ischemia miocardica.
• Sono eleggibili per la terapia trombolitica e la PCI
primaria dovrebbe essere eseguita da personale non esperto.
• Intervento oltre 12 h dall’inizio dei sintomi
e senza evidenza di ischemia miocardica. (ev.C)
Da ACC/AHA Percutaneous Coronary Intervention Guidelines JACC
2001
L’efficacia
del trattamento con PTCA primaria potrebbe, altrimenti essere
inficiato dall’aumento del numero di complicanze. I dati
in Italia sono comunque incoraggianti: il numero di PTCA primarie
passa da 6871 nel 2001 a 9010 nel 2002 (dati GISE Società
Italiana di Cardiologia Invasiva, www.gise.it).
Il CAPTIM study che correla la fibrinolisi precoce (in ambulanza)
con l’angioplastica primaria nell’IMA non ha mostrato,
invece, differenze significative tra i due gruppi, anche se
un elevato numero di pazienti sono stati poi avviati ad una
strategia di rivascolarizzazione percutanea.
I pazienti con controindicazioni alla terapia fibrinolitica
o aggravati da un’elevata morbilità e mortalità
dovrebbero essere candidati alla PTCA primaria.
Alla luce dei dati di una sottoanalisi del CAPTIM, sono riportate
di seguito le conclusioni sul trattamento del paziente con infarto
miocardico acuto:
- Per i pazienti che giungono all’osservazione del medico
molto precocemente dopo l’inizio dei sintomi, la fibrinolisi
in ambulanza, se possibile, è il trattamento più
appropriato e può essere seguita dall’angioplastica,
se necessaria.
- I pazienti che non possono essere sottoposti a fibrinolisi
nelle ore “d’oro”, cioè da due a tre
dopo l’inizio dei sintomi, ma che non possono essere sottoposti
ad angioplastica, devono essere trattati mediante PCI anche
se è necessario il trasporto in un ospedale con laboratorio
di emodinamica.
- I pazienti che si presentano dopo due o tre ore dall’inizio
dei sintomi, ma che non possono essere sottoposti a trattamento
percutaneo entro le successive due ore, devono essere sottoposti
a fibrinolisi (ad eccezione dei pazienti che presentano controindicazioni),
quindi possono essere stratificati per un’immediata o
differita PCI aggiuntiva.
- Per i pazienti che si presentano all’osservazione dopo
sei ore dall’inizio dei sintomi, dovrebbe essere effettuata
l’angiografia coronarica seguita dall’angioplastica
o dal by-pass.
Non è chiaro se in pazienti asintomatici, la strategia
di una PTCA di routine dell’arteria colpevole dell’infarto
dopo trombolisi eseguita con successo, mostra benefici per ciò
che riguarda la sopravvivenza, il recupero di più tessuto
miocardico o la prevenzione del reinfarto o della morte. In
alcuni studi questo approccio è associato ad un aumento
dell’incidenza di eventi avversi, come sanguinamenti,
ischemia ricorrente, chirurgia coronarica d’urgenza e
morte. Tali studi che hanno valutato gli effetti dell’angioplastica
sistematica dopo trombolisi (e che hanno messo la PCI primaria
dopo trombolisi in classe III) sono però stati effettuati
in epoca pre-stent e pre-inibitori della GP IIb/IIIa. Lo studio
GRACIA, ha invece dimostrato il possibile beneficio di una angioplastica
effettuata di routine dopo la trombolisi.
Studi osservazionali hanno valutato l’utilizzo di PTCA
in pazienti con shock cardiogeno Per i pazienti che non hanno
una causa meccanica di shock (cause meccaniche: insufficienza
mitralica acuta o rottura del SIV post-infartuale) la mortalità
è minore in quelli trattati con PCI rispetto alla terapia
medica. Una strategia di rivascolarizzazione meccanica precoce
è generalmente raccomandata nei pazienti di età
< 75 anni che presentano IMA complicato da shock cardiogeno
dovuto ad un prevalente scompenso del ventricolo sinistro.
Lo studio SHOCK, ha messo a confronto una strategia di rivascolarizzazione
precoce (PTCA o intervento cardiochirurgico) con un’iniziale
strategia di tipo conservativo inclusa la fibrinolisi e l’uso
del contropulsatore aortico; questo trial ha dimostrato il beneficio
di una precoce strategia invasiva solo per i soggetti maschi
con età < 75 anni. La riduzione della mortalità
a 30 giorni è risultata <20% (46.7 vs 56.0%; il tasso
di mortalità ad 1 mese era del 45.3% per i pazienti che
venivano sottoposti a PTCA e del 42.1% per quelli che venivano
sottoposti ad intervento cardiochirurgico).
Linee Guida AHA/ACC (2001) per la PCI dopo trombolisi
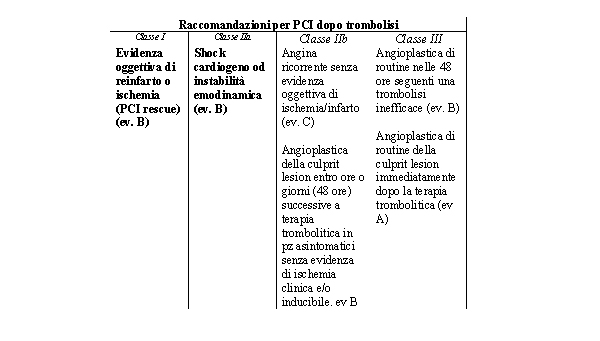
Raccomandazioni
per PCI dopo trombolisi
Classe I Classe IIa Classe IIb Classe III
Evidenza oggettiva di reinfarto o ischemia (PCI rescue) (ev.
B) Shock cardiogeno od instabilità emodinamica (ev. B)
Angina ricorrente senza evidenza oggettiva di ischemia/infarto
(ev. C)
Angioplastica
della culprit lesion entro ore o giorni (48 ore) successive
a terapia trombolitica in pz asintomatici senza evidenza di
ischemia clinica e/o inducibile. ev B Angioplastica di routine
nelle 48 ore seguenti una trombolisi inefficace (ev. B)
Angioplastica
di routine della culprit lesion immediatamente dopo la terapia
trombolitica (ev A)
Da ACC/AHA Percutaneous Coronary Intervention Guidelines JACC
2001
Una
correlazione positiva tra strategia di rivascolarizzazione precoce
e mortalità ad 1 mese è stata riscontrata nei
pazienti maschi di età < 75 anni, tempo intercorrente
tra inizio dell’IMA e randomizzazione < 6 ore e storia
di pregresso IM.
Una correlazione negativa tra strategia di riperfusione precoce
e mortalità ad 1 mese, invece, è riscontrata nelle
donne, ed in pazienti di età > 75 anni. A 6 mesi,
la mortalità totale per tutte le cause era più
bassa nel gruppo sottoposto a rivascolarizzazione precoce che
nel gruppo che aveva ricevuto terapia medica per la stabilizzazione
(50.3 vs 63.1%).
Il tasso di mortalità comunque molto elevato nel gruppo
sottoposto a rivascolarizzazione precoce, può avere diverse
spiegazioni: il tasso di successo della PTCA è rimasto
molto basso fino agli ultimi 2 anni dell’arruolamento
dei pazienti, infatti solo il 58% dei pazienti raggiungeva un
flusso TIMI 3 dopo la procedura.
Questi risultati alquanto deludenti possono essere spiegati,
almeno in parte, dal limitato uso degli stents nei primi 4 anni
di arruolamento. Infatti, una PTCA di successo determinava una
riduzione della mortalità (38%) se raffrontata con il
tasso di mortalità dei pazienti con procedura insoddisfacente
(79%).
In secondo luogo, il ritardo tra l’esordio dello shock
cardiogeno ed il trattamento è risultato eccessivamente
lungo: il tempo medio tra l’inizio dell’IMA e la
diagnosi di shock era di 5 ore, e il tempo medio tra l’inizio
dell’IMA e la randomizzazione era di ben 11 ore; il ritardo
tra la randomizzazione e il trattamento risultava di 0.9 ore
per la PTCA e di 2.7 ore per l’intervento cardiochirurgico.
Perciò, i pazienti che venivano sottoposti a PTCA ricevevano
un trattamento dopo un tempo medio di 12 ore dall’inizio
dell’IMA, e di 7 ore dopo la diagnosi di shock.
Questo ritardo del trattamento può in parte spiegare
i risultati relativamente scarsi nei pazienti arruolati nello
studio SHOCK.
Questi aspetti sono compatibili con i risultati di studi precedenti21
i quali hanno dimostrato che il beneficio della riperfusione
nei pazienti in stato di shock è strettamente dipendente
dal tempo.
Dunque, si potrebbe dedurre che un più elevato tasso
di successo della PTCA con l’impiego di stent, potrebbe
essere associato alla riduzione del tempo intercorrente dalla
diagnosi di shock al trattamento.
È importante sottolineare che nello studio GUSTO I ed
in altri studi riguardanti la fibrinolisi, solo lo 0.8% dei
pazienti presentava uno stato di shock all’ammissione,
sebbene la maggioranza dei pazienti che hanno sviluppato shock
venivano inizialmente classificati in classe Killip I.
Questo dato suggerisce l’opportunità di considerare
un intervento di rivascolarizzazione meccanica primaria per
tutti i pazienti ad alto rischio di shock, così come
per i pazienti con IMA esteso, infarto ricorrente, pregresso
intervento di bypass aorto-coronarico, età avanzata.
Secondo le linee guida italiane vi è un alto livello
di evidenza a favore del beneficio della rivascolarizzazione
precoce nello shock cardiogeno ed è raccomandata una
precoce strategia di tipo invasivo in tutti i pazienti con IMA
complicato dal sopravvento di uno shock cardiogeno, senza alcuna
restrizione basata sull’età o sul sesso, ad eccezione
di quei casi in cui l’intervallo di tempo intercorrente
tra l’inizio dello shock ed il trattamento sia così
lungo da ridurre l’efficacia della terapia riperfusiva
(shock cardiogeno irreversibile dovuto a disfunzione del microcircolo).
Le più recenti linee guida sono quelle della Società
Europea di Cardiologia sull’IMA (2003) e sugli interventi
coronarici percutanei (2005)18.
L’angioplastica primaria definita come angioplastica o
stenting senza precedente o concomitante trattamento fibrinolitico
è, secondo le linee guida dell’ESC 2003, l’opzione
terapeutica da preferire entro 90’ dal primo contatto
medico e quando è presente personale esperto di cardiologia
interventistica.
La prima PCI primaria fu effettuata nel 1979, solo due anni
dopo l’avvento dell’angioplastica. Da allora molti
studi clinici randomizzati hanno documentato la superiorità
di questa metodica rispetto alla trombolisi. Sembra, inoltre,
che il maggiore beneficio da questa terapia lo traggano le donne
e i pazienti anziani.
Una sessione cospicua delle linee guida ESC 2005 sull’angioplastica
è stata dedicata all’IMA con sopraslivellamento
del tratto ST.
Linee Guida ESC (2003): raccomandazioni alla terapia riperfusiva
dopo IMA
Terapia
riperfusiva |
Raccomandazioni |
Classe
I |
Classe
IIa |
Classe
IIb |
Classe
III |
Livello
di evidenza |
La
terapia riperfusiva è indicata in tutti i pazienti
con storia di dolore toracico <12 h associato con sopraslivellamento
del tratto ST od insorgenza di nuovo blocco di branca
sinistra all’ECG |
X |
|
|
|
A |
Angioplastica
primaria: |
|
|
|
|
|
Trattamento
preferito se effettuato da team esperto entro 90’
dal primo contatto medico |
X |
|
|
|
A |
Pz
in shock o con contro-indicazioni alla terapia fibrinolitica |
X |
|
|
|
C |
Utilizzo
degli Inibitori delle GP IIb/IIIa in angioplastica primaria.
Senza stent
|
X |
|
|
|
A |
Utilizzo
degli Inibitori delle GP IIb/IIIa in angioplastica primaria.
Con stent
|
|
X |
|
|
A |
Angioplastica
rescue: |
|
|
|
|
|
Dopo
trombolisi inefficace in pazienti con infarto esteso |
|
X |
|
|
B |
Trattamento
fibrinolitico: |
|
|
|
|
|
In
assenza di controindicazioni e se la PCI primaria non
può essere effettuata entro 90’ o non è
presente personale esperto |
X |
|
|
|
A |
La
scelta dell’agente fibrinolitico dipende dalle condizioni
generali del rapporto rischio-beneficio dalla disponibilità
e dai costi. In pazienti che arrivano tardi all’osservazione
(>4h dall’inizio dei sintomi) sono da preferire
tenecteplase od alteplase. |
X |
|
|
|
A |
Inizio
della terapia fibrinolitica nella fase di pre-ospedalizzazione. |
X |
|
|
|
B |
Risomministrazione
di un agente litico non immunogenico se c’è
evidenza di riocclusione e non è possibile la riperfusione
meccanica. |
|
X |
|
|
B |
Terapia
con aspirina (150-325 mg) in assenza di controindicazioni. |
X |
|
|
|
A |
Terapia
con eparina (sec peso corporeo) in pazienti che hanno
ricevuto alteplase e reteplase. Somministrare precocemente
e riaggiustare frequentemente il dosaggio sec aPTT. |
X |
|
|
|
B |
Terapia
con eparina opzionale se è stata utilizzata Streptochinasi. |
|
X |
|
|
B |
Le
linee guida specificano che la PCI nell’IMA con ST sopra
richiede un team esperto di cardiologi interventisti. Ciò
significa che solo gli ospedali con un reparto di cardiologia
interventistica organizzato per le urgenze dovrebbe effettuare
l’angioplastica al posto della trombolisi nei pazienti
con STEMI.
Secondo le linee guida ESC 2005 su PCI il percorso diagnostico-terapeutico
più appropriato del paziente con IMA e sopraslivellamento
del tratto ST può essere riassunto come segue:
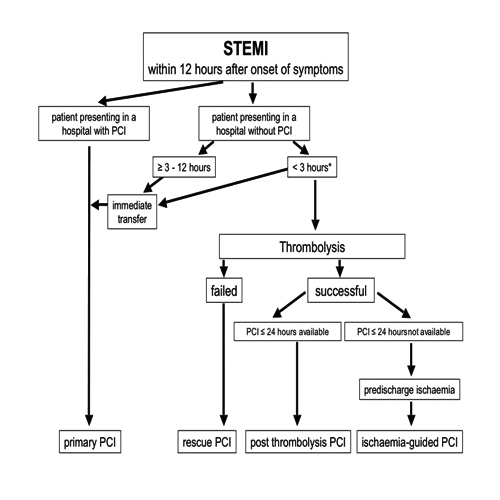
In pazienti con malattia aterosclerotica coronarica multivasale,
la PCI primaria dovrebbe essere effettuata, in acuto, solo sull’arteria
responsabile dell’infarto (culprit vessel), procrastinando
la decisione circa la rivascolarizzazione delle altre lesioni
in base all’evidenza di ischemia residua al follow up
tardivo.
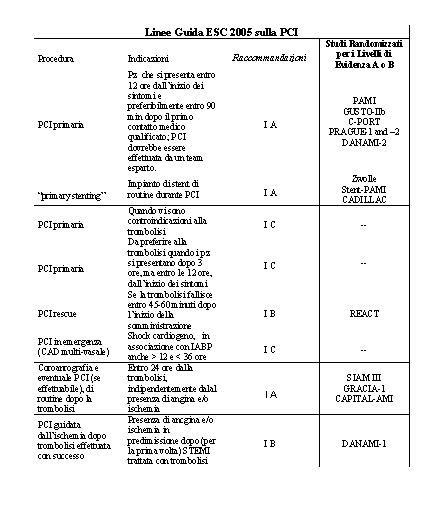
Linee
Guida ESC 2005 sulla PCI
Procedura Indicazioni Raccommandazioni Studi Randomizzati per
i Livelli di Evidenza A o B
PCI primaria Pz che si presenta entro 12 ore dall’inizio
dei sintomi e preferibilmente entro 90 min dopo il primo contatto
medico qualificato; PCI dovrebbe essere effettuata da un team
esparto. I A PAMI
GUSTO-IIb
C-PORT
PRAGUE-1 and –2
DANAMI-2
“primary stenting” Impianto di stent di routine
durante PCI I A Zwolle
Stent-PAMI
CADILLAC
PCI primaria Quando vi sono controindicazioni alla trombolisi
I C --
PCI primaria Da preferire alla trombolisi quando i pz si presentano
dopo 3 ore, ma entro le 12 ore, dall’inizio dei sintomi
I C --
PCI rescue Se la trombolisi fallisce entro 45-60 minuti dopo
l’inizio della somministrazione I B REACT
PCI in emergenza (CAD multi-vasale) Shock cardiogeno, in associazione
con IABP
anche > 12 e < 36 ore I C --
Coroanrografia e eventuale PCI (se effettuabile), di routine
dopo la trombolisi Entro 24 ore dalla trombolisi, indipendentemente
dalal presenza di angina e/o ischemia I A SIAM III
GRACIA-1
CAPITAL-AMI
PCI guidata dall’ischemia dopo trombolisi effettuata con
successo Presenza di ancgina e/o ischemia in predimissione dopo
(per la prima volta) STEMI trattata con trombolisi I B DANAMI-1
IL TRASFERIMENTO DEI PAZIENTI CON IMA (HUB & SPOKE).
In quest’ottica è sorto il nuovo problema di stabilire
se l'angioplastica primaria effettuata dopo trasferimento del
paziente dal centro di riferimento (Spoke) a un ospedale dotato
di cath lab in grado di effettuare angioplastiche primarie 24
ore su 24 (Hub), dia risultati comunque superiori alla terapia
fibrinolitica somministrata all'ospedale di riferimento. Considerando
il ritardo insito nel trasferimento ed i rischi connessi al
trasporto durante l'infarto miocardico acuto, la risposta non
è intuitiva.
Alla luce dei risultati dei trials clinici più recenti
(DANAMI 2 e PRAGUE 2)6,7 e di una recente metanalisi di Zijlstra4
che hanno dimostrato la superiorità dell’angioplastica
primaria anche quando il paziente deve essere trasferito presso
un laboratorio di emodinamica distante dal centro di riferimento,
la questione da dibattere non è più se valga la
pena di organizzare un sistema di trasferimento dei pazienti
con infarto acuto, ma come organizzarlo e con quali supporti
farmacologici in funzione del rischio del paziente e del “door-to-balloon
time”.
A tal fine, è importante sottolineare che il 96% dei
pazienti arruolati in questi trials sono stati trasferiti dagli
ospedali di riferimento ai centri dove veniva effettuata l’angioplastica
entro due ore dalla randomizzazione. L’analisi di questi
dati rivela che, nonostante il ritardo connesso al trasferimento
(in media 43 minuti), la PTCA primaria si associata a una significativa
riduzione della percentuale di morte, re-IMA non fatale e stroke.
Inoltre, il trasferimento è risultato sicuro e fattibile,
in quanto gli eventi avversi durante il trasporto sono stati
infrequenti (0.5% di mortalità e 0.7-1.4% di aritmie
ventricolari).
Un’altra metanalisi è stata pubblicata nell’Ottobre
2003 da Montelescot et al.; sono stati inclusi tutti gli studi
in cui è stata confontata la fibrinolisi in situ con
il trasferimento presso un centro dove veniva effettuata l’angioplastica
primaria. L’endopoint primario è stato un composito
di morte, re-IMA e stroke a 30 giorni. I trials inclusi nella
metanalisi sono il Maastricht, il PRAGUE 1 e 2, l’Air-PAMI,
il CAPTIM e il DANAMI 2. I risultati hanno dimostrato che l’angioplastica
primaria determina una significativa riduzione del rischio relativo
riguardante l’end point combinato; anche quando analizzati
separatamente, il rischio di re-IMA e stroke era significativamente
ridotto nel gruppo che aveva effettuato angioplastica primaria.
Anche la morte era stata ridotta dall’angioplastica primaria,
pur se in maniera non significativa. Tale differenza, diventa
invece, statisticamente significativa, se dalla metanalisi si
esclude lo studio CAPTIM, uno studio che differisce dagli altri
in quanto la randomizzazione e quindi la somministrazione della
terapia fibrinolitica veniva effettuata precocemente, nella
fase pre-ospedaliera; inoltre, molti pazienti assegnati al braccio
fibrinolisi, sono stati poi inviati al cath lab per effettuare
angioplastica rescue.
Un recente articolo8 ha dimostrato che, nei pazienti con IMA
e ST sopraslivellato, il parametro che più si correla
alla mortalità è il “symptom-onset-to-balloon
time” piuttosto che il “door-to-balloon time”,
soprattutto nei pazienti non a basso rischio e in quelli con
flusso preprocedurale TIMI 0. Inoltre, un “symptom-onset-to-balloon
time” superiore alle 4 ore è stato identificato
come predittore indipendente di mortalità ad un anno.
L’angioplastica primaria presenta problemi logistici non
indifferenti e di non immediata soluzione in estese aree del
nostro territorio nazionale. Al momento attuale, si configurano
almeno tre possibili situazioni logistiche:
-centri in cui è disponibile, in sede o nelle immediate
vicinanze,un laboratorio di cardiologia interventistica attivo
24 ore su 24 (“door-to-balloon time” entro 90 min);
in questi centri sembra proponibile, e nella maggior parte dei
casi è già attiva, una strategia di angioplastica
primaria sistematica o, al più, limitata ai casi a rischio
intermedio-elevato;
-centri in cui, per distanza fisica o problemi organizzativi,
il “door-to-balloon time”sia 90-180 min, ma comunque
tale da non rendere proibitivo il trasferimento dei pazienti,
per lo meno di quelli in cui sia fortemente consigliabile una
rivascolarizzazione d’emergenza;
-centri, infine, per cui il “door-to-balloon time”
sia proibitivo per una strategia di angioplastica primaria anche
selettiva.
La recente espansione delle possibilità farmacologiche
di riperfusione miocardica precoce nell’infarto miocardico,
e la maggiore attenzione all’integrazione di strategie
farmacologiche e meccaniche, ancorché in via di evoluzione,
sembra promettere un miglioramento della prognosi dell’infarto
miocardico acuto, soprattutto nei pazienti a rischio più
elevato.
La ricanalizzazione farmacologica dell’arteria responsabile
dell’IMA richiede la combinazione di un attivatore del
plasminogeno, un farmaco antipiastrinico e uno antitrombinico
per due motivi: innanzitutto perché il trombo fresco
è costituito di fibrina (che si forma mediante il meccanismo
trombinico e si dissolve mediante la lisi plasminica) e piastrine;
in secondo luogo, perché la lisi del trombo mediante
terapia fibrinolitica induce uno stato protrombotico che deve
essere contrastato mediante antipiastrinici e anticoagulanti,
pena la riocclusione.
Strategie possibili, al fine di trarre il maggiore vantaggio
dalle opzioni attualmente disponibili sono:
- La selezione dei pazienti in cui il beneficio della riperfusione
meccanica sia maggiore o irrinunciabile, o il rischio emorragico
non sostenibile a fronte di una strategia alternativa;
- Rendere farmacologicamente proficuo il tempo di trasferimento
mediante farmaci specifici, specialmente quando si prevedano
tempi lunghi per la riapertura meccanica dell’arteria
responsabile dell’IMA.
Esistono pazienti, quali quelli con evoluzione verso lo shock
o con classe Killip elevata, per i quali da tempo la rivascolarizzazione
meccanica è considerata obbligatoria. Il beneficio dell’angioplastica
coronarica appare inoltre maggiore nei pazienti con infarto
miocardico esteso, precedente infarto miocardico, ipotensione-tachicardia.
Questi pazienti vanno individuati già al primo contatto
medico e inviati presso il centro più idoneo.
Secondo le linee guida dell’ESC 20035, l’angioplastica
primaria è l’opzione terapeutica da preferire entro
90’ dal primo contatto medico e quando è presente
personale esperto in cardiologia interventistica Solo nell’impossibilità
di un rapido trasferimento per angioplastica primaria, andranno
privilegiate le strategie trombolitiche9,10.
Più discusse, e materia di studi randomizzati attualmente
in corso, sono le scelte nei casi di elevata distanza temporo-spaziale
dalla sala di emodinamica. Due opzioni sono attualmente in corso
di valutazione in assenza di dati adeguati sia sull’efficacia
che sulle modalità: l’angioplastica facilitata
e l’angioplastica di salvataggio o “rescue ”.
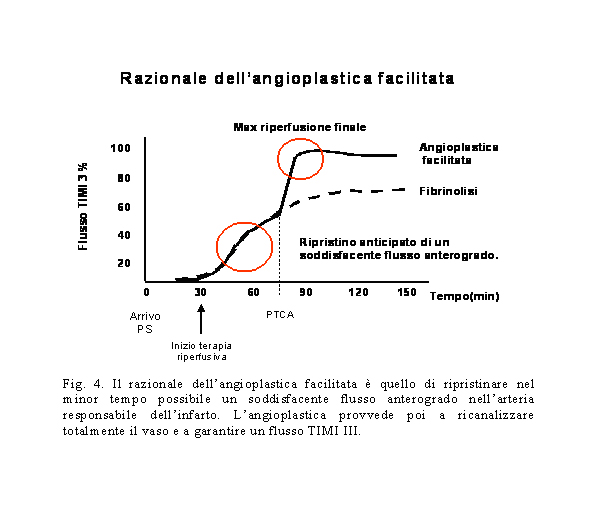
L’ANGIOPLASTICA
FACILITATA.
Per angioplastica facilitata si intende una procedura effettuata
previa somministrazione di inibitori della GP IIb/IIIa e basse
dosi di fibrinolitico in paziente con infarto miocardico acuto.
La terapia farmacologica usualmente viene somministrata, durante
il trasporto, prima che il paziente giunga in emodinamica. Il
razionale di questa terapia combinata (figura 4) è quello
di tentare di ricanalizzare farmacologicamente l’arteria
responsabile dell’IMA prima della ricanalizzazione meccanica,
riducendo così il tempo di ischemia e salvando miocardio
vitale11. La somministrazione di farmaci antitrombotici e/o
litici avrebbe, inoltre, il vantaggio di facilitare la ricanalizzazione
meccanica del vaso, di ridurre la massa trombotica e di rendere
meno reattiva la superficie piastrinica sia a livello del trombo
colpevole (minore probabilità di riocclusione precoce)
che a livello periferico (minore rischio di “no-reflow”).
Al momento attuale, non vi sono dati conclusivi né sulla
reale efficacia dell’angioplastica facilitata, né
su quale sia eventualmente la migliore strategia farmacologica,
anche se alcuni studi sono attualmente in corso.
Tre opzioni sono state valutate in studi di piccole dimensioni:
t-PA in singolo bolo, abciximab da solo e abciximab più
solo il bolo (mezza dose) di t-PA.
Nello studio SPEED12 sono stati arruolati 484 pazienti divisi
in gruppi ai quali veniva somministrato rispettivamente abciximab,
con e senza bassa dose di reteplase, solo reteplase e terapia
sec protocollo standard di reteplase. I risultati di questo
trial dimostrano che il trattamento con reteplase+abciximab
è correlato ad una precoce e completa riperfusione. Dati
simili sono stati riportati da altri trial come il GUSTO I13
ed il GUSTO IV14.
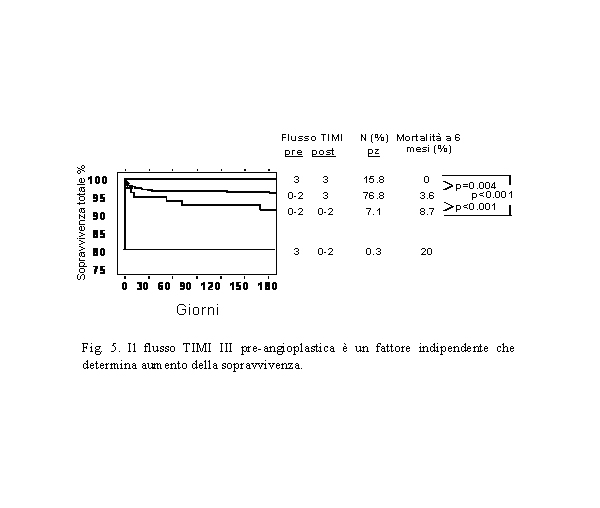
I diversi trials hanno ovviamente dimostrato una maggiore percentuale
di normale flusso nell’arteria responsabile (flusso TIMI
III) pre-angioplastica e sono promettenti soprattutto in termini
di recupero della funzione contrattile ventricolare sinistra
a distanza. È, inoltre, stato dimostrato che la presenza
di un normale flusso anterogrado (TIMI III) nell’arteria
responsabile dell’IMA prima dell’angioplastica è
un fattore indipendente che determina un aumento della sopravvivenza
(Figura 5). Nello studio ADMIRAL15 l’utilizzo di abciximab
prima della procedura di angioplastica primaria ha dimostrato
una maggiore pervietà del vaso responsabile dell’
IMA con un flusso TIMI III pre-angioplastica del 16.8% nel gruppo
trattato con reopro rispetto al 5.4% del gruppo controllo (p<0.01).
L’abciximab ha inoltre determinato un miglioramento degli
end points combinati a sei mesi. Il TIGER Trial16 è uno
studio prospettico pilota, randomizzato il cui scopo è
stato quello di valutare l’efficacia, la sicurezza e la
fattibilità della somministrazione precoce di tirofiban
prima dell’angioplastica primaria.
Sono stati arruolati nello studio 100 pazienti in cui i sintomi
dell’infarto erano comparsi da meno di 12 ore, di questi,
50 sono stati assegnati ad una precoce strategia riperfusiva
(somministrazione di tirofiban (10 mg/kg in 3’ + 0.15
mg/kg/min x 24 h) ed eparina sodica (70 UI/kg + 5 UI/kg/h) in
pronto soccorso, e successivo trasferimento presso il laboratorio
di emodinamica) e 50 sono stati assegnati a ricevere in pronto
soccorso la sola eparina sodica alla dose di 100 UI/kg + 10
UI/kg/h e successivamente trasferiti per effettuare l’angioplastica
primaria durante la quale veniva somministrato il tirofiban
allo stesso dosaggio.
I dati dello studio dimostrano che il flusso TIMI III pre-angioplastica
nel gruppo assegnato alla terapia farmacologica precoce era
significativamente maggiore rispetto a quello del gruppo di
controllo (32% vs 10%, p<0.007). Nessuna differenza significativa
tra i due gruppi è stata, invece, dimostrata per quanto
concerne l’incidenza di stroke o altri eventi emorragici
sia maggiori che minori.
SI
PUÒ IPOTIZZARE UNA STRATEGIA DI TRANSFERIMENTO (NELLE
SEI ORE) IN TUTTI I PAZIENTI GIÀ TROMBOLISATI PER EFFETTUARE
UN’ANGIOPLASTICA ?
Nell’Agosto 2003 è stato pubblicato su JACC il
SIAM III trial (Southwest German Study in Acute MI III), uno
studio tedesco in cui sono stati arruolati 163 pazienti con
IMA inizialmente trattati con bolo di reteplase, acido acetilsalicilico
ed eparina nell’ospedale di riferimento e successivamente
randomizzati in due gruppi:
1) immediato trasferimento in un centro dotato di cath-lab dove,
entro 6 ore dalla somministrazione di reteplase, veniva effettuata
l’angioplastica con impianto di stent dell’arteria
responsabile dell’infarto
2) stabilizzazione clinica dopo terapia fibrinolitica e invio
al laboratorio di emodinamica, circa due settimane dopo l’evento
acuto, per effettuare angioplastica elettiva dell’arteria
responsabile dell’IMA.
I risultati dello studio hanno dimostrato una significativa
riduzione dell’end point primario (morte, re-IMA, eventi
ischemici e rivascolarizzazione del vaso responsabile dell’IMA)
a 6 mesi, nel gruppo in cui è stata effettuata l’angioplastica
dopo la trombolisi (con trasferimento entro le sei ore) rispetto
al gruppo in cui la rivascolarizzazione meccanica è stata
procrastinata. La percentuale di complicanze emorragiche è
risultata comparabile nei due gruppi.
L’ANGIOPLASTICA
RESCUE.
Per angioplastica di salvataggio o “rescue” si intende
una procedura effettuata dopo trombolisi inefficace in pazienti
con ischemia miocardia ricorrente o continua (in genere dopo
90’). Questo approccio, effettuato in una fase intermedia,
determina la ricanalizzazione dell’arteria responsabile
dell’infarto con conseguente miglioramento della cinetica
segmentaria e riduzione degli eventi avversi rispetto a una
procedura eseguita in elezione in tempi più tardivi.
Le linee guida ACC/AHA (2001)21 consigliano di effettuare la
PTCA dopo trombolisi solo in caso di pazienti con infarto ed
ischemia ricorrente (Classe I), o in quelli con shock cardiogeno
e/o instabilità emodinamica (Classe IIa). Le linee guida
italiane (FIC, ANMCO, SIC 2002)17 sottolineano che un accertamento
precoce non invasivo dell’efficacia della terapia trombolitica
permette la rapida diagnosi di trombolisi inefficace ed il conseguente
trasferimento del paziente per l’intervento di rivascolarizzazione
meccanica. L’elevato pericolo di un intervento di tipo
meccanico rilevato in vecchi studi con PTCA convenzionali necessita
di una rivalutazione dal momento che, con l’uso degli
stents e degli inibitori delle GP IIb/IIIa, le percentuali di
successo e le complicanze periprocedurali sono comparabili a
quelle di una angioplastica primaria effettuata in assenza di
terapia fibrinolitica. Gli studi eseguiti all’inizio degli
anni ’90 hanno dato risultati non conclusivi per le loro
piccole dimensioni, per la mancanza di un’adeguata terapia
antitrombotica di supporto e per la fase pionieristica in cui
si trovava l’angioplastica coronarica, con il risultato
di uno scarso utilizzo di questa opzione.
Linee
Guida AHA/ACC (2001) per la PCI durante ricovero in reparto
dopo terapia trombolitica acuta per l’IMA

Raccomandazioni
per PCI durante ricovero in reparto dopo terapia trombolica
acuta per l’IMA inclusa la PCI primaria
Classe I Classe IIa Classe IIb Classe III
Ischemica miocardica spontanea od indotta durante il ricovero
per IMA (ev C)
Persistente
instabilità emodinamica (ev C) Pazienti con FE<40%,
scompenso cardiaco congestizio od importanti aritmie ventricolari
(ev C)
Coronarografia ed PCI di un’arteria occlusa in pazienti
altrimenti stabili per ricanalizzare il vaso (teoria del vaso
pervio) (ev. C)
Tutti
i pazienti dopo un IMA non Q (ev.C)
Insufficienza cardiaca in acuto con successivo ripristino della
funzione ventricolare sinistra (FE>40%) (ev. C) Angioplastica
della culprit lesion nelle 48-72 ore dopo terapia trombolitica
senza evidenza di ischemia spontanea od inducibile (ev. C)
In
realtà, l’angioplastica “rescue” ha
un grande potenziale terapeutico, soprattutto nei centri che
non dispongono di un laboratorio di emodinamica, in particolare
nei pazienti più a rischio (infarti estesi, reinfarti
e in generale nei casi di instabilità emodinamica) e
alla luce dell’attuale strategia farmacologica di combinazione
di anti-GP IIb/IIIa e fibrinolitico in grado di riaprire l’arteria
responsabile in oltre il 70% dei casi, preparando altresì
un terreno favorevole per una successiva angioplastica. Il potenziale
pratico è quello di iniziare la terapia farmacologica
nel centro periferico e di trasferire urgentemente il paziente
solo nel caso di mancata riperfusione o di situazione di instabilità
emodinamica.
Questi problemi irrisolti sono alla base di alcuni trials attualmente
in corso sulle strategie riperfusive combinate farmacologiche
e meccaniche.
Tra gli studi in corso si annovera il CARESS, uno studio condotto
dalla Società Italiana di Cardiologia Invasiva-Gise,
il cui scopo è quello di paragonare l’efficacia
di due diverse strategie riperfusive in pazienti ad alto rischio
con infarto miocardico acuto e sopraslivellamento del tratto
ST:
- Terapia con Abciximab e r-TPA a mezza dose, con la possibilità
di effettuare l’angioplastica rescue in caso di fallimento
della terapia farmacologica;
- Invio elettivo al laboratorio di emodinamica per effettuare
l’angioplastica facilitata dopo una precoce somministrazione
di Abciximab e mezza dose di r-TPA.
Secondo quanto affermato nel documento congiunto FIC/ANMCO/SIC17
sul trattamento dei pazienti con IMA le possibili strategie
terapeutiche sono:
- solo trombolisi per tutti i pazienti con IMA (modello ormai
insufficiente);
- PTCA primaria per i pazienti con shock cardiogeno e per quelli
non eleggibili per la trombolisi (modello “minimo”
da garantire ovunque);
- PTCA rescue per pazienti con trombolisi inefficace (modello
“minimo” da garantire ovunque);
- PTCA primaria per pazienti con IMA ad alto rischio (modello
standard da implementare progressivamente in tutta Italia);
- PTCA primaria per tutti i pazienti con IMA (modello attuabile
in poche realtà).
Possibili integrazioni possono essere rappresentate dalla trombolisi
preospedaliera e dall’angioplastica facilitata mediante
pre-trattamento con inibitori della GP IIb/IIIa in ambulanza
o nel centro periferico.
Alla luce di quanto affermato la scelta del percorso terapeutico
per il paziente con IMA deve essere effettuata tenendo conto
di diverse variabili:
a)
Tempo dall’insorgenza del dolore e livello del centro:
- > 12 ore Centro di I o II livello (centro con unità
di terapia intensiva od UTIC);
- > 6 e < 12 ore: criterio di preferenza per l’invio
in Emodinamica (specie per i pazienti ad alto rischio);
- < 6 ore: stratificazione prognostica (PCI nei pazienti
ad alto rischio).
b)
Rischio-severità del quadro clinico ed ECG:
- complicanze “meccaniche”:?centro di IV livello
(Cardiochirurgia);
- shock e controindicazioni alla trombolisi: emodinamica;
- rischio elevato: tempo per l’Emodinamica < 90’:
inviare in emodinamica (± inibitore GP IIb/IIIa);
tempo per l’Emodinamica > 90’: inviare a centro
di I o II livello per trombolisi. Emodinamica per PTCA in caso
di trombolisi inefficace.
- rischio medio-basso: inviare a centro di I o II livello per
trombolisi. Emodinamica per eventuale PTCA in caso di trombolisi
inefficace, da valutare nel singolo caso.
c)
Tempo di trasporto al Laboratorio di Emodinamica.
d)
Criteri di stratificazione prognostica (definire la combinazione
di criteri adatta alla propria realtà), prognosi peggiore
è associata con: età> 75 anni; pressione sistolica
+?100 mmHg e frequenza cardiaca > 100 b/min; TIMI risk score
+ ?5; infarto anteriore/esteso, ?4 derivazioni con tratto ST
sopraslivellato; precedente infarto etero-sede; precedente by-pass
aortocoronarico.
LA
RETE INTEROSPEDALIERA PER L’INFARTO MIOCARDICO ACUTO:
L’IMPORTANZA DELL’ ORGANIZZAZIONE

I
dati della letteratura riguardanti l’efficacia dell’
angioplastica primaria anche in pazienti trasferiti a centri
di cardiologia interventistica rafforzano l’importanza
della creazione di una rete interospedaliera. Il trattamento
ottimale dell’infarto miocardio acuto richiede, pertanto,
importanti scelte di politica sanitaria ed organizzative.
Cioè è necessaria la creazione di una rete istituzionalizzata
che colleghi i laboratori di emodinamica con le UTIC, i reparti
di pronto soccorso e cardiologia e il 118. L’esecuzione
dell’angioplastica primaria va, infatti, organizzata nell’ambito
delle reti interospedaliere ed eseguita nei Centri che, per
le caratteristiche strutturali e di know-how, siano in grado
di garantire risultati in linea con quelli ottenuti negli studi
di riferimento (in termini di tempi di esecuzione , di complicanze
e di outcome ospedaliero); si ritiene che questi Centri debbano
avere un bacino d’utenza minimo di circa 400.000 abitanti
ed avere un volume di PTCA di almeno 400 procedure/anno. È
auspicabile che il protocollo di indicazioni e trattamenti farmacologici
associati sia unico e condiviso fra i Centri collegati ed è
indispensabile un registro di tutti gli IMA ricoverati, che
permetta una valutazione adeguata dell’attività
svolta e degli outcomes clinici.
La Società Italiana di Cardiologia Invasiva – Gise
ha dedicato una sessione degli Stati Generali svoltisi a Maggio
2003 alla realizzazione della “RETE INFARTO”.
Durante la riunione si è deciso di non analizzare i presupposti
scientifici che identificano nella PTCA primaria il miglior
trattamento disponibile dell’IMA, nè eventuali
strategie farmacologiche aggiuntive, ma si è voluto discutere
come renderla disponibile per il maggior numero possibile di
pazienti colpiti dall’IMA, indipendentemente dall’ospedale
al quale afferiscono.
I temi discussi durante la riunione sono stati i seguenti:
1) Quali caratteristiche strutturali e di know-how deve avere
un centro che esegue l’angioplastica primaria ?
2) Se si opta per le organizzazioni in reti interospedaliere,
chi e come organizzarle e quali sono i problemi prevedibili?
3) Come relazionarsi all’ANMCO (e SIC e FIC) e alle UTIC
che rappresenta, nell’ambito delle reti?
4) Come finanziare l’incremento dell’attività
che deriva dalla gestione interospedaliera dei pazienti?
Quali
caratteristiche strutturali e di know-how deve avere un centro
che esegue l’angioplastica primaria ?
Le domande che sono state poste sono state: Si può ipotizzare
una diffusione dell’angioplastica primaria in tutte le
Cardiologie dotate di Laboratorio di emodinamica? E’ realizzabile
un progetto di potenziamento delle emodinamiche diagnostiche
ai fini della esecuzione della PTCA primaria ? Per fare ciò
è necessaria una organizzazione particolare poichè
circa il 60-65% delle procedure viene effettuata al di fuori
dell’orario del lavoro. Per ottenere risultati soddisfacenti
è necessario che le procedure in emergenza siano eseguite
dalla stessa equipe che effettua procedure elettive.
È pertanto necessario istituire un servizio di reperibilità
del personale medico e paramedico del laboratori di emodinamica
24 ore su 24 per 365 giorni l’anno. La normativa contrattuale,
però, non permette di superare i 6 gg/mese di reperibilità.
Quindi, se l’equipe è composta da 1 medico, 2 infermieri
professionali (+ un eventuale tecnico), per garantire la reperibilità,
l’organico di una Unità di Emodinamica dovrebbe
essere composto da almeno 4 medici, 8 infermieri e 4 tecnici,
tutti perfettamente addestrati (N.B. questi numeri sono comunque
opportuni, indipendentemente).
Per disporre di un tale numero di medici e infermieri professionali
addestrati (+ eventuali tecnici), ogni emodinamica deve avere
una attività diagnostica ed interventistica adeguata
(almeno più di 400 PTCA/anno) ed un bacino d’utenza
sufficiente per mantenerla (circa 400.000).
Quindi, l’obiettivo primario non è la diffusione
indiscriminata della PTCA primaria, né l’improvvisazione
della implementazione dei laboratori diagnostici per eseguire
l’angioplastica primaria se mancano presupposti logistici
e il bacino d’utenza adeguato, bensì la creazione
della rete interospedaliera (Hub and Spoke).
Chi
deve organizzare la rete interospedaliera, come e quali sono
i problemi prevedibili?
L’organizzazione e la gestione delle reti è il
risultato di uno sforzo comune, realizzabile soltanto se si
è realmente convinti. I soggetti interessati sono:
a) I laboratori di emodinamica
b) Le UTIC
c) I cardiologi operanti nelle strutture ospedaliere
d) Le associazioni scientifiche (ANMCO, SIC, GISE, FIC)appresentanti
del 118 e del PS
e) Organi regionali.
La rete dovrebbe essere organizzata, secondo quanto emerso dagli
Stati Generali del Gise, in maniera congiunta da tutti gli interessati.
I problemi principali da affrontare e risolvere saranno: convincere
le UTIC periferiche che non perderanno né i loro pazienti,
né il ruolo gestionale dell’IMA, organizzare i
trasporti dal centro spoke al centro hub e implementare l’attività
dei centri hub.
Il problema della diffidenza delle UTIC periferiche è
superabile soltanto con la chiarezza dei rapporti e con il riinvio
più rapido possibile del paziente al centro di provenienza.
È inoltre opportuno e auspicabile che vi sia un coinvolgimento
paritario delle UTIC nelle attività scientifiche in tema
di sindromi coronariche acute.
Uno dei problemi maggiori, malvissuto dai cardiologi e dal 118,
è quello del trasporto del paziente critico dal centro
spoke a quello hub. Questo deve essere organizzato in modo tale
che il paziente giunga al centro hub in meno di 90 minuti. Non
esiste una soluzione univoca a questo problema: ogni singolo
ospedale dovrà trovare soluzioni locali, in base al proprio
organico ai rapporti interni con i medici del pronto soccorso,
con gli anestesisti e con il 118 territoriale. Se il trasporto
viene effettuato dal 118 è, però, prioritario
che il paziente venga gestito come codice rosso e non come trasporto
secondario.
È da sottolineare che durante il trasporto dei pazienti
arruolati nello studio DANAMI 2, il medico non era presente
e il paziente veniva assistito da un infermiere adeguatamente
addestrato. Questa opportunità molto interessante non
è però attuabile a breve in Italia. Infine, le
regioni e le direzioni degli ospedali dovrebbero tener conto
che un incentivo economico (gettone per il trasporto) potrebbe
facilitare la disponibilità dei medici e aiutare a risolvere
il problema.
Per incrementare l’attività dei centri hub, ogni
laboratorio dovrà trovare soluzioni interne adeguate
circa la propria attività interventistica. Per quanto
riguarda l’incremento delle degenze in UTIC, questa è
in parte mitigata dal rinvio rapidissimo dei pazienti (la maggior
parte entro le 24 ore) e dall’accorciamento complessivo
delle degenze in pazienti con IMA trattati mediante angioplastica
primaria.
L’altro annoso problema emerso dalla riunione degli Stati
Generali del Gise è come la società deve relazionarsi
alle altre associazioni scientifiche (ANMCO, SIC e FIC). È
sicuramente importante dare una nuova valenza ai Laboratori
di Emodinamica nella gestione dell’IMA, perlomeno paritaria
a quello delle UTIC. L’ostacolo deve essere comunque superato
nell’ambito dei rapporti fra le Società Scientifiche
(GISE vs ANMCO/SIC, FIC); dalla riunione è emersa la
volontà di non creare battaglie né prese rigide
di posizione perché la soluzione troverà un suo
naturale sviluppo strada facendo, quando i laboratori di emodinamica
avranno acquisito una maggiore forza contrattuale conquistata
sul campo operativo. Tuttavia, le altre Società devono
riconoscere fin da subito e ufficialmente il nuovo ruolo dei
laboratori di emodinamica nella gestione dell’IMA con
conseguente diretto coinvolgimento in tutte le valutazioni programmatiche,
negli studi clinici, ecc.
La strutturazione della rete prevede, però, più
lavoro e costi maggiori per ogni singolo paziente; un solo infarto
impegnerà 2 centri anzichè 1, 4 medici invece
di 1 solo, etc. Nel centro spoke, infatti, oltre al cardiologo
che normalmente avrebbe completato tutto l’iter diagnostico-terapeutico,
si deve attivare un altro medico (cardiologo reperibile, anestesista,
medico PS, 118) per il trasporto; nel centro hub dovrà
essere attivato l’emodinamista (che sarebbe rimasto a
dormire) e il medico dell’UTIC (che non avrebbe mai visto
il paziente). Tutto ciò non può funzionare senza
alcun incremento dei costi, pertanto sarà necessario
creare progetti regionali di finanziamento finalizzati all’organizzazione
della rete o stabilire convenzioni extra DRG fra gli ospedali
coinvolti con la possibilità di eseguire la PCI primaria
in regime di libera professione od ancora utilizzare finanziamenti
locali specifici delle ASL.
In conclusione:
1) L’esecuzione dell’angioplastica primaria andrebbe
organizzata nell’ambito delle reti interospedaliere ed
eseguita nei Centri che per le caratteristiche strutturali e
di know-how siano in grado di garantire i risultati in linea
con quelli ottenuti negli studi di riferimento (in termini di
tempi di esecuzione, di complicanze e di outcome ospedaliero);
si ritiene che questi Centri debbano avere un bacino d’utenza
minimo di circa 400.000 abitanti ed avere un volume di PTCA
di almeno 400/anno.
2)
Il protocollo di indicazioni e trattamenti farmacologici associati
deve essere unico e condiviso fra i Centri collegati ed è
indispensabile un registro di tutti gli IMA ricoverati, che
permetta una valutazione adeguata dell’attività
svolta e degli outcomes clinici.
L’organizzazione e la gestione delle reti è il
risultato di uno sforzo comune, realizzabile soltanto se si
è realmente convinti. I soggetti interessati sono:
a) Cardiologi operanti nelle strutture ospedaliere,
b) le associazioni scientifiche (ANMCO, SIC, GISE, FIC, ecc.),
c) rappresentanti del 118 e del PS,
d) organi regionali.
I
problemi principali da affrontare e risolvere saranno:
a) convincere le cardiologie periferiche che non perderanno
né i loro pazienti né il ruolo gestionale dell’IMA;
b) organizzazione dei trasporti interospedalieri che dovranno
necessariamente permettere l’arrivo del paziente in emodinamica
in meno di 90’;
c) organizzare l’attività delle emodinamiche 24ore
su 24 e fare fronte ad un afflusso di pazienti superiore allo
standard abituale nei centri interventistici.
In ogni realtà locale e regionale vanno ricercati i percorsi
specifici, basati necessariamente sulle situazioni già
esistenti.
3)
Nell’ambito dei rapporti del GISE con altre Società
Scientifiche (ANMCO, SIC, FIC) sia a livello nazionale che regionale,
va ricercato il riconoscimento del nuovo ruolo dei laboratori
di emodinamica e degli emodinamisti nella gestione dell’IMA;
questo riconoscimento dovrà concretizzarsi tramite il
coinvolgimento diretto in tutte le fasi decisionali di tipo
programmatico, organizzativo e scientifico, oltre che nei documenti
ufficiali che riguardano questo tema.
4)
L’incremento dell’attività complessiva nell’ambito
di una gestione interospedaliera dell’IMA, difficilmente
potrà essere realizzata senza una adeguata copertura
finanziaria; le modalità per il reperimento dei fondi
vanno individuate localmente; lo sviluppo dei progetti regionali
finalizzati è comunque applicabile in tutte le Regioni.
5)
L’esecuzione dell’angioplastica primaria nell’ambito
della rete intraospedaliera può essere effettuata quando
sono soddisfatti gli standard di qualità gia menzionati,
con particolare enfasi relativamente ai tempi necessari per
il trasferimento.
BIBLIOGRAFIA
1)
Primary Angioplasty for Acute Myocardial Infarction. Is It Worth
the Wait?
Alice K. Jacobs, M.D. N Engl J Med 2003, 349(8):798-800
2) Primary angioplasty versus intravenous thrombolytic therapy
for acute myocardial infarction: a quantitative review of 23
randomised trials.Ellen C Keeley, Judith A Boura, Cindy L Grines
Lancet 2003; 361:13–20
3) SHould We Emergently Revascularize Occluded Coronaries for
Cardiogenic ShocK Judith S. Hochman JAMA 2001;285:190-192
4) Angioplasty vs thrombolysis for acute myocardial infarction:
a quantitative overview of the effects of interhospital transportation.
Zijlstra F European Heart Journal 2003 Jan;24(1):21-3
5) Management of Acute Myocardial Infarction in Patients Presenting
with ST-segment Elevation European Society of Cardiology European
Heart Journal, 2003; 24: 28-66
6) DANAMI-2: The Danish trial in acute coronary angioplasty
in acute myocardial infarction. Andersen H. Clin Cardiol 2002;
301
7) Long distance transport for primary angioplasty vs immediate
thrombolysis in acute myocardial infarction: final results of
the randomized national multicentre trial — PRAGUE-2.
Widimsky P, Budesinsky T, Vorac D, et al.European Heart Journal
2003;24:94-104.
8) Symptom-onset-to-balloon time and mortality in patients with
acute myocardial infarction treated
by primary angioplasty.De Luca G, Suryapranata H, Zijlstra F,
van't Hof AW, Hoorntje JC,
Gosselink AT, Dambrink JH, de Boer MJ; ZWOLLE Myocardial Infarction
Study Group.
J Am Coll Cardiol, Sep 17; 42(6):991-7.
9) Guideline Updatwe for the Manegement of Patients With Unstable
Angina and Non-ST-Segment Elevation Myocardial Infarction American
College of Cardiology/American Heart Association 2002 Journal
of the American College of Cardiology, March 2002.
10) Guideline for the Management of Patients With Acute Myocardial
Infarction
American College of Cardiology/American Heart Association 1999Circulation,
1999; 100: 1016-1030.
11) Guideline for Percutaneous Coronary Intervention American
College of Cardiology/American Heart Association 2001 Journal
of the American College of Cardiology 2001; 37: 2239i-lxvi.
12) Facilitation of early PCI after reteplase with or without
abciximab in AMI - SPEED (GUSTO 4 PILOT)Eric J. Topol et al.Journal
of American College of Cardiology 2000;36:1489-96
13) Global Use of Strategies To Open Occluded Coronary Arteries
in Acute Coronary Syndrome-I. GUSTO I Allan M. Ross et al.Journal
of American College of Cardiology 1998;31:1511-1517
14) Global Use of Strategies To Open Occluded Coronary Arteries-IV-Acute
Coronary Syndromes - GUSTO IV ACS Martin Simoons et al.Lancet
2001;357:1915-24
15) Abciximab Before Direct Angioplasty and Stenting in Myocardial
Infarction Regarding Acute and Long-term Follow-up- ADMIRAL
Trial Gilles Montalescot et al.New England Journal of Medicine
2001;344:1895-1903
16) Adjunctive platelet glycoprotein IIb/IIIa receptor inhibition
with tirofiban before primary angioplasty improves angiographic
outcomes: results of the TIrofiban Given in the Emergency Room
before Primary Angioplasty (TIGER-PA) pilot trial. Lee DP, Herity
NA, Hiatt BL, Fearon WF, Rezaee M, Carter AJ, Huston M, Schreiber
D, DiBattiste PM, Yeung AC; TIrofiban Given in the Emergency
Room before Primary Angioplasty.
Circulation. 2003 Mar 25;107(11):1497-501
17) Documento di Consenso Infarto miocardico acuto con ST elevato
persistente: verso un appropriato percorso diagnostico-terapeutico
nella comunità.
Federazione Italiana di Cardiologia (FIC), Associazione Nazionale
Medici Cardiologi Ospedalieri (ANMCO), Società Italiana
di Cardiologia (SIC). In press 2005
18) Guidelines for Percutaneous Coronary Interventions (PCI)
The Task Force for Percutaneous Coronary Interventions of the
European Society of Cardiology. European Heart Journal 2005










