FARMACOLOGIA
CLINICA DEGLI INIBITORI SELETTIVI DEL COLESTEROLO
Alberto
Corsini
Dipartimento di Scienze Farmacologiche, Università degli
Studi di Milano, Milano
Numerose
evidenze epidemiologiche documentano come elevati livelli plasmatici
di colesterolo, in particolare colesterolo LDL, siano associati
ad un aumentato rischio di insorgenza di patologie cardiovascolari
(1). Ne consegue che la conoscenze sui meccanismi fisio-patologici
alla base dell’omeostasi del colesterolo nell’organismo
sono fondamentali per poter controllare l’ipercolesterolemia
in modo mirato ed altamente significativo. E’ noto che
due sono le principali fonti del colesterolo plasmatico: la
sintesi epatica e l’assorbimento intestinale di colesterolo
(Fig.1). (1,2) Il contenuto totale di colesterolo in una persona
adulta del peso di circa 70 kg è di 140 g ma solo lo
1% (1200 mg) va incontro a un ricambio giornaliero. Ogni giorno
noi assumiamo dalla dieta circa 300-500 mg di colesterolo e
100g di trigliceridi. Questi lipidi si assemblano con circa
900 mg di colesterolo biliare e con gli acidi biliari al fine
di formare delle micelle che permettono l’assorbimento
di questo colesterolo di origine intestinale. Circa il 50% di
tutto il colesterolo che è presente nell’intestino
tenute viene assorbito dalla mucosa intestinale, il rimanente
viene perso nelle feci (2). Una quota analoga di colesterolo
viene sintetizzata a livello epatico ad evidenziare un contributo
equipollente delle due vie nel fornire quotidianamente l’organismo
di colesterolo. La terapia farmacologica delle ipercolesterolemie
prevede essenzialmente l’impiego degli inibitori della
HMG-CoA riduttasi (statine). Questi farmaci sono in gradi di
inibire in modo altamente significativo (50%) la sintesi epatica
del colesterolo a cui si associa un’aumentata espresiione
del recettore per le LDL ed una riduzione delle LDL plasmatiche
(1). Questa classe di farmaci ha ampiamente documentato come
una riduzione del colesterolo LDL sia effettivamente associata
ad una riduzione del rischio cardiovascolare (3). Recentemente,
tre studi condotti con dosaggi elevati di simvastatina (80 mg)
e/o atorvastatina (80 mg) verso dosaggi bassi o a statine con
minor potenza hanno dimostrato in pazienti sia con angina instabile
(studio PROVE-IT, A-to-Z) sia con angina stabile (TNT –
New Engl. J. 2005) una riduzione più significativa degli
eventi cardiovascolari a supporto della ipotesi che una maggiore
riduzione del colesterolo determini un maggiore beneficio clinico.
Tuttavia se questi studi da un lato documentano e confermano
l’importanza di un approccio aggressivo al colesterolo
LDL dall’altro hanno documentato come elevati dosaggi
siano tuttavia associati ad aumentato rischio di miopatie, degli
enzimi epatici ed anche della mortalità non cardiovascolare.
Queste ultime considerazioni suggeriscono come una terapia combinata
sia potenzialmente più favorevole rispetto ad una terapia
con dosaggi elevati di statine nel ridurre il colesterolo LDL.
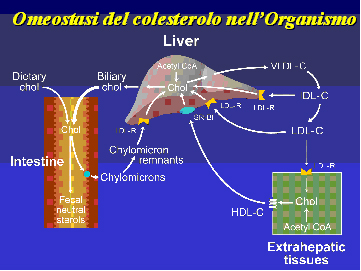
Figura 1
Queste evidenze cliniche, hanno contribuito alla preparazione
di nuove Linee Guida Internazionali che enfatizzano l’importanza
di ridurre in modo sempre più aggressivo i livelli di
colesterolo LDL circolanti soprattutto in pazienti ad alto rischio
cardiovascolare (4). Nonostante queste premesse, a tutt’oggi,
la monoterapia con statine non sempre permette il raggiungimento
dei livelli di colesterolo considerati ottimali dalle varie
linee guida internazionali. In effetti, la percentuale dei pazienti
in cui è stata raggiunta un livello di colesterolemia
suggerita dalla linea guida poteva oscillare in modo considerevole,
variando tra il 9 e il 50%. Recenti analisi condotte in Italia
hanno confermato soltanto in una piccola percentuale dei pazienti
con un rischio cardiovascolare elevato in terapia con statina
il raggiungimento dell’obiettivo terapeutico. In particolare,
uno studio osservazionale, trasversale, è stato disegnato
per analizzare la frequenza del trattamento con statine in una
coorte di pazienti assistiti dall’Azienda Unità
Sanitaria Locale (ASL) di Ravenna, in un periodo di osservazione
corrispondente all’intero 2001. La Coorte degli assistiti
era costituita complessivamente da 66.736 pazienti e il valore
di colesterolemia era noto per 9.208 pazienti. Sulla base degli
aumentati livelli di colesterolo e del profilo di rischio cardiovascolare,
i pazienti potenzialmente eleggibili per una terapia con statine
ammontava a 7.233. Tuttavia il numero dei pazienti che riceveva
un trattamento con statina era significativamente più
basso, 1.343 pazienti corrispondenti al 18.6%. Inoltre, tra
tutti i pazienti esposti al trattamento con statine, soltanto
in 271, un valore corrispondente fino al 20,2% dei casi, è
stato raggiunto un livello plasmatico di colesterolo totale
ottimale scodo le linee guida internazionali. Complessivamente
da questo studio sono emerse due informazioni di primaria rilevanza:
nonostante sussistesse la precisa indicazione al trattamento,
un numero molto ridotto di pazienti è stato esposto ad
una terapia con statine e il livello plasmatico ottimale di
CT è stato ottenuto solo nel 20% circa dei soggetti trattati
(5).
Diverse sono le ragioni (Tab 1) che possono determinare una
risposta insoddisfacente alla terapia con statine che chiaramente
suggeriscono e supportano la necessità di interventi
associati al fine di ottimizzare il controllo dell’ipercolesterolemia
e quindi potenzialmente di ridurre ulteriormente il rischio
cardiovascolare del paziente.
Tabella
1. Fattori che influenzano la risposta ipolipidemizzante al
trattamento con statine
Fattori
estrinseci
Scarsa adesione al trattamento
Dieta
Tempo di somministrazione
Terapie concomitanti
Fattori
intrinseci (determinati geneticamente)
Mutazioni del recettore per le LDL
Mutazioni dell’apoproteina B 100
Velocità di sintesi del colesterolo
Polimorfismo apoproteina E
Polimorfismo CETP
Polimorfismo CYP2D6
(adattata da Corsini, A. – ref, 6)
Tra
le cause di una scarsa risposta al trattamento con statine oltre
a problemi di adesione al e di incompatibilità al trattamento,
vanno ricordati fenomeni di resistenza al trattamento alle statine.
Questi “poor responders” (7,8) sono di solito caratterizzati
da una bassa sintesi di colesterolo endogeno ed un assorbimento
aumentato di colesterolo. Tali considerazioni associate alle
numerose evidenze epidemiologiche che correlano i livelli di
colesterolo plasmatico LDL con la percentuale di colesterolo
assorbito a livello intestinale (9), sottolineano come l’assorbimento
del colesterolo rappresenti un potenziale bersaglio per un intervento
terapeutico mirato a controllare questa componente fondamentale,
insieme alla sintesi endogena, del bilancio omeostatico del
colesterolo nell’organismo (Fig1)
Recentemente, nuovi acquisizioni si sono ottenute in particolare
sui meccanismi coinvolti nell’assorbimento di colesterolo
di origine sia biliare sia dietetica a livello intestinale.
In particolare, l’assorbimento di colesterolo prevede
un meccanismo specifico mediato da una proteina trasportatrice
localizzata a livello dell’orletto a spazzola delle cellule
intestinali (10); la proteina NPC1L1, espressa a livello della
membrana dell’enterocita, sembra essere la candidata a
svolgere tale ruolo (10-12).
Questa proteina di 145 kDa è fondamentale nel controllare
l’omeostasi del colesterolo nell’enterocita (11-12).
In particolare, la sua espressione è modulata dal contenuto
intracellulare di colesterolo nell’enterocita: la proteina
risulta aumentata nella sua espressione in cellule con basso
contenuto di colesterolo e viceversa in presenza di elevati
livelli. È bene ricordare che il colesterolo presente
nell’intestino deriva solo parzialmente dalla dieta e
per la maggior parte ha infatti origine endogena (9). Questo
trasporto specifico è fondamentale per il successivo
trasferimento nell’enterocita dove il colesterolo, una
volta esterificato, viene assemblato insieme ai trigliceridi
nei chilomicroni. I chilomicroni vengono sottoposti a idrolisi
enzimatiche catalizzate da diverse lipasi e, a seguito della
deplezione dei trigliceridi e all’arricchimento in colesterolo,
i chilomicroni “remnants”, vengono captati a livello
epatico. Il colesterolo così captato determinerà
sia una ridotta sintesi endogena sia una ridotta espressione
dei recettori per le LDL con un potenziale aumento dei livelli
circolanti di LDL. Una inibizione dell’assorbimento di
colesterolo comporterà una minor disponibilità
dello steroide a livello epatico, un’aumentata captazione
delle LDL ed una riduzione dei livelli plasmatici di colesterolo
LDL (13,14).
Inibitori
dell’assorbimento del colesterolo: ezetimibe
Farmacologia:
Meccanismo d’azione
Gli inibitori dell’assorbimento del colesterolo, quale
ezetimibe (13-15), non influenzano i meccanismi che si verificano
quando il colesterolo si trova nell’enterocita ma, selettivamente,
inibiscono l’assorbimento intestinale del
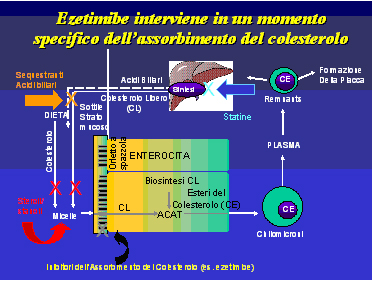
Figura 2
colesterolo
dietetico e biliare a livello dell’orletto a spazzola
delle cellule intestinali (Fig 2).
Il meccanismo alla base dell’inibizione dell’assorbimento
del colesterolo da parte di ezetimibe è legato alla modulazione
in senso inibitorio della proteina trasportatrice NPC1L1 (10-12).
Recentemente è stato documentato mediante studi di legame
come effettivamente ezetimibe sia in grado di legarsi in modo
spefico e ad un singolo sito agli enterociti sia di roditori
sia di primati (13). Nelle medesime condizioni sperimentali
si è osservato come ezetimibe non sia in grado di legarsi
alla stessa preparazione ottenuta da eneterociti di topini a
cui era stato soppresso (KO) il gene che codificava per la proteina
NPC1L1. Questi studi di cinetica di legame confermano appieno
il meccanismo specifico attraverso il quale il composto è
in grado di interferire con l’assorbimento del colesterolo
(13). Questa specificità d’azione è ulteriormente
rinforzata dal fatto che ezetimibe non inibisce l’attività
di enzimi pancreatici, non sequestra acidi biliari e colesterolo,
non influenza l’attività di esterificazione ne
tanto meno le attività delle lipasi presenti nel tratto
gastrointestinale (14). Questa selettività nell’inibire
il trasporto di colesterolo è documentata dall’assenza
di interferenza di ezetimibe sull’assorbimento di trigliceridi,
estrogeni, progestinici e vitamine liposolubili.. L’inibizione
selettiva operata da ezetimibe impedisce il trasferimento dal
lume intestinale all’interno della cellula del colesterolo
e ne favorisce l’escrezione (14).
Va infine ricordato come l’inibizione a livello dell’orletto
a spazzola evita tutte quelle interazioni che sono state documentate
con l’impiego dei sequestranti degli acidi biliari, quali
le resine, che impediscono l’assorbimento non solo di
acidi biliari, ma anche una serie di molecole lipofili di notevole
importanza biologica quali vitamine liposolubili e gli ormoni
steroidei.
Nell’uomo la capacità di ezetimibe di inibire l’assorbimento
del colesterolo del 54% rispetto al placebo è associata
ad una riduzione dei livelli plasmatici del 20% del colesterolo
LDL, del 15% del colesterolo totale, del 7% dei trigliceridi
ed un aumento del 2.7% delle HDL (15,16). La riduzione del colesterolo
LDL solo dal 20% rispetto ad una inibizione dell’assorbimento
del colesterolo del 40-50% è da attribuirsi ad una risposta
omeostatica dell’organismo che ne aumenta la sintesi endogena
(14,15). L’ezetimibe è stata approvata per un suo
impiego in terapia dalla FDA nell’ottobre 2002 ed è
in commercio e/o registrazione in molte nazioni europee
Farmacocinetica
L’ezetimibe viene rapidamente assorbita in seguito alla
somministrazione orale e, una volta ingerita, è rapidamente
captata dalle cellule intestinali e convertita nel suo derivato
glucuronide attraverso la catalisi indotta da 3 diversi glucuroniltransferasi
(17) in un metabolita farmacologicamente attivo e, solo in una
piccola porzione (4%) è ossidata ad un chetone. A causa
della rapida glucuronidazione, circa il 90% della concentrazione
plasmatica totale di ezetimibe, misurata a mezz’ora dalla
somministrazione, è costituita dal suo derivato glucuronide.
La concentrazione massima di ezetimibe si osserva entro le 4-12
ore dalla somministrazione, mentre la concentrazione massima
del glucuronide si osserva tra 1 e 2 ore dalla somministrazione
del principio attivo. L’assorbimento non è influenzato
dalla presenza di cibo. A seguito della sua formazione, il composto
glucurodinato è rilasciato al fegato dal sistema portale
e riescreto nel lume intestinale attraverso la via biliare dove
è in grado di legarsi alla parete intestinale. Più
del 95% della dose somministrata di ezetimibe si riscontra come
glucuronide nel lume intestinale o a livello della cellula intestinale
suggerendo che la scarsa distribuzione sistemica del composto
non coniugato è da attribuirsi alla veloce conversione
nel suo metabolita attivo. L’ezetimibe così come
il suo derivato glucuronide sono altamente legati alle proteine
plasmatiche (<90%). Il volume apparente di distribuzione
di ezetimibe è di circa 105-107L in accordo con un suo
tropismo e con il suo concentrarsi a livello intestinale. L’andamento
concentrazione plasmatica-tempo mostra la comparsa di diversi
picchi che suggeriscono il ricircolo enteroepatico di ezetimibe.
Circa il 17% del complesso ezetimibe-glucuronide va incontro
a distacco del glucuronide nel lume intestinale e alla riformazione
di ezetimibe che viene quindi riassorbita nell’ileo. Questo
circolo enteroepatico si verifica ogni 4 ore per diverse volte
(17). A seguito del circolo enteroepatico di ezetimibe è
quindi difficile stimare la vera emivita di eliminazione che
tuttavia si calcola intorno alle 28-30 ore. Il circolo enteroepatico
è di notevole importanza proprio per prolungare l’effetto
farmacodinamico di ezetimibe sull’assorbimento del colesterolo.
Sulla base di studi condotti con composti radiomarcati, l’80%
di ezetimibe viene eliminato principalmente come tale nelle
feci e il 10% eliminato per via renale principalmente nella
forma glucuronide. Numerosi studi condotti in popolazioni speciali
documentano come nell’anziano (> 65 anni) le concentrazioni
plasmatiche siano raddoppiate anche se si osserva un effetto
ipolipidemizzante sovrapponibile al giovane. L’ezetimibe
è stata studiata anche negli adolescenti (10-18 anni)
che hanno documentato una farmacocinetica sovrapponibile. Nella
donna le concentrazioni sono circa il 20% superiori ma a parità
tuttavia di efficacia ipolipidemizzante. Condizioni di nefropatia
e di epatopatia sono associate ad un aumento seppur moderato
delle concentrazioni plasmatiche del farmaco evidentemente legate
alle patologie a carico degli organi fondamentali nell’eliminazione
del farmaco che ne comporterà una variazione posologica.
Al contrario non sono richiesti aggiustamenti posologici per
l’ezetimibe in presenza di cibo, nell’anziano, nel
giovane e tra sesso maschile e femminile (17).
Studi
Clinici: la Doppia Inibizione
A supporto della necessità di un intervento mirato a
controllare non solo la sintesi endogena ma anche l’assorbimento
del colesterolo intestinale per l’intervento ipocolesterolemizzante
più completo, sono i dati recentemente confermati e pubblicati
dal gruppo di Miettinen (18) che hanno documentato come un trattamento
con statine, in particolare atorvastatina nello studio, determini
un aumento della quota di colesterolo assorbito (Tab 2).
I risultati, come dimostrato in tabella, evidenziano chiaramente
come le statine determinano, per una risposta omeostatica dell’organismo
alla necessità di colesterolo, parallelamente un’inibizione
della sintesi endogena, un aumento della quota assorbita. Da
questi studi emerge ancora una volta la necessità di
un intervento a due livelli proprio per il controllo ottimale
del colesterolo plasmatico.
Numerosi studi clinici hanno previsto l’impiego di 10
mg/ die di ezetimibe e hanno dimostrato la sua efficacia nell’aumentare
l’effetto ipolipidemizzante del 15-26%, quando associata
a qualsiasi statina (19-21).
Tabella
2. Effetto della atorvastatina sull’omeostasi del colesterolo
nell’organismo
Variabile
|
Prima
|
Durante
|
Variazioni
|
| Assorbimento
del colesterolo % |
26
+ 2 |
53
+ 5 |
+103
+ 1_* |
| Acidi
biliari fecali |
424
+ 84 |
371
+ 89 |
-2
+ 21 |
| Sintesi
del colesterolo |
1078
+ 269 |
551
+ 105 |
-42
+ 8*¬_ |
| Colesterolo
della dieta |
241
+ 49 |
300
+ 33 |
+4
+ 19 |
| Assorbimento |
65
+ 16 |
153
+ 8 |
+187
+ 57* |
| Colesterolo
intestinale |
1208
+ 139 |
1016
+ 87 |
-18
+ 8 |
| Assorbimento |
314
+ 43 |
536
+ 69 |
+82
+ 32* |
| Sitosterolo
dalla dieta |
232
+ 33 |
195
+ 14 |
-10
+ 12 |
| Media
+ ES |
| *
P< 0.05 o minore |
Questi
risultati sono stati recentemente confermati in uno studio randomizzato,
doppio cieco condotto su più di 3.000 pazienti, denominato
“EASE” (Ezetimibe Add-on to Statin for Effectivenss),
(22). I pazienti inclusi erano nel 77% dei casi affetti da malattia
coronarica conclamata e nel 17% dei casi avevano almeno 2 fattori
di rischio cardiovascolare. Tutti i pazienti erano in trattamento
stabile (atorvastatina, simvastatina, pravastatina e fluvastatina)
ma non avevano raggiunto il colesterolo LDL ottimale secondo
le linee guida NCEP-ATP III (1). In questo studio, l’associazione
di ezetimibe alla terapia statinica in corso ha prodotto una
riduzione addizionale della colesterolemia LDL del 23-26% contro
il 2-6% del placebo, permettendo così al 71% dei pazienti
di raggiungere il loro obiettivo terapeutico, rispetto al 21%
dei pazienti del braccio di confronto. Recentemente uno studio
condotto da Ballantyne e coll. (23) ha confrontato l’efficacia
e la sicurezza della co-somministrazione ezetimibe più
simvastatina verso la monoterapia di atorvastatina in pazienti
ipercolesterolemici. Lo studio prevedeva di saggiare diversi
dosaggi da 10 a 80 mg di atorvastatina rispetto ai 10-80 di
simvastatina in presenza di 10 mg di ezetimibe. L’aumento
nel dosaggio era previsto ogni 6 settimane nello stesso paziente
secondo. I risultati hanno dimostrato una maggior riduzione
delle LDL, un maggior aumento del colesterolo HDL nei pazienti
trattati con la co-somministrazione ezetimibe e simvastatina
verso atorvastatina in monoterapia a suggerire l’impatto
da un punto di vista pratico della co-somministrazione in termini
di sicurezza ma soprattutto di efficacia sul profilo lipidico.
Questo duplice effetto di inibizione dell’assorbimento
e aumentata sintesi endogena di colesterolo costituisce il razionale
per la terapia di associazione con inibitori della sintesi del
colesterolo endogena quale le statine (Fig 2). La figura 2 riassume
i principali interventi mirati al controllo del metabolismo
del colesterolo sia di origine intestinale sia di origine epatica.
Si evince molto chiaramente che la duplice inibizione a livello
dell’enterocita operata da ezetimibe e a livello dell’epatocita
dalla statina, costituisce la vera novità nell’approccio
terapeutico delle dislipidemie proprio per le diverse caratteristiche
farmacodinamiche dei due agenti terapeutici e per la specificità
della loro azione. Associata a questa duplice inibizione che
ne esalta le proprietà farmacodinamiche e gli effetti
ipolipidemizzanti va ricordato il profilo di sicurezza e tollerabilità
osservata negli studi di associazione. Studi di fase I hanno
chiaramente dimostrato che l’ezetimibe (10 mg) non interagisce
con caffeina, tolbutamide, destrometorfano, dapsone o midazolam
ad evidenziare l’assenza di interazione con i citocromi
CYPIA2, CYP2C8, CYP2C9, CYP2D6, CYP3A4 e con la N-acetiltransferasi
(17). L’ezetimibe inoltre non modifica la cinetica delle
statine (Tab 3) (14,15,24). Per quanto riguarda la combinazione
tra ezetimibe e fibrati la letteratura a riguardo è tutt’oggi
piuttosto scarsa e non definitiva. In particolare, due studi
cinetici condotti con ezetimibe in presenza sia di gemfibrozil
sia di fenofibrato hanno documentato un aumento dei livelli
plasmatici di un 50-80% dell’ezetimibe associata ad entrambi
i trattamenti (24,25). Queste ricerche lasciano aperto il rischio
che questa combinazione non sia ottimale proprio per un aumentato
livello di ezetimibe seppur compatibile con la variabilità
interindividuale da un punto di vista cinetico. Dall’altro
lato un recente studio condotto (26) da Farnier e coll. ha documentato
come la co-somministrazione di ezetimibe con fenofibrato porta
ad una efficacia complementare sia sulle LDL ridotte del 20%
sia sui trigliceridi ridotti del 40% sia sugli aumentati livelli
del colesterolo HDL (19%) in pazienti con dislipidemia mista
a suggerire che questa terapia porta a un migliorato profilo
lipidico associato ad una riduzione delle LDL piccole e dense.
lipoproteine altamente aterogene. Questi dati sono ovviamente
di supporto ad una potenziale combinazione ezetimibe-fenofibrato.
Le uniche due interazioni che sono di rilevanza clinica si verificano
quando ezetimibe è combinata con ciclosporina e colestiramina.
Nel primo caso, le concentrazioni di ezetimibe aumentano di
3-10 volte quando associate a ciclosporina nei pazienti trapiantati
renali. Ne consegue che questa co-somministrazione deve essere
valutata ed utilizzata con estrema cautela (17). Al contrario
la co-somministrazione con colestiramina determina un ridotto
assorbimento di ezetimibe; pertanto l’eventuale co-somministrazione
deve prevedere una posologia che prevede la somministrazione
di ezetimibe 2 ore prima o 4 ore dopo la somministrazione delle
resine. Riassumendo, sia il colesterolo di origine endogena
(sntesi) sia di origine esogena (assorbimento intestinale) contribuiscono
a determinare i livelli plasmatici di colesterolo e delle lipoproteine
coinvolte nel suo trasporto: entrambi i processi possono essere
modulati farmacologicamente.
Tabella
3. Ezetimibe: studi di interazioni tra farmaci
Farmaco |
Indicazione
terapeutica |
Farmaco
- farmaco interazione |
Atorvastatina |
Ipolipidemizzante |
No |
Simvastatina |
Ipolipidemizzante |
No |
Fluvastatina |
Ipolipidemizzante |
No |
Lovastatina |
Ipolipidemizzante |
No |
Rosuvastatina |
Ipolipidemizzante |
No |
Pravastatina |
Ipolipidemizzante |
No |
Cumetidine |
Antiulcera |
No |
Digossina |
Antiaritmici |
No |
Glipizide |
Ipolipidemizzante |
No |
Norgestrel
+ etinilestradiolo |
Contraccettivo |
No |
Warfarina |
Anticoagulante |
No |
Colestiramina |
Ipolipidemizzante |
Si |
Gemfibrozil |
Ipolipidemizzante |
Si |
Fenofibrato |
Ipolipidemizzante |
Si
/ No |
Ciclosporina |
Immunosoppressore |
Si |
In particolare, la sintesi può essere controllata in
modo efficiente dalle statine mentre l’assorbimento può
essere ridotto inibendone l’assorbimento (ezetimibe).
Ne consegue che la combinazione di farmaci con meccanismi complementari
nel controllo del colesterolo plasmatico, la doppia inibizione,
può rappresentare l’approccio terapeutico ottimale
per il controllo dell’ipercolesterolemia in pazienti ad
alto rischio cardiovascolare.
REFERENZE
1.
Executive Summary of The Report of the National Cholesterol
Education Program (NCEP) Export Panel of Detection, Evaluation,
and Treatment of Hight Blood Cholesterol in Adults (Adult Treatment
Panel III). JAMA 2001;285:2486-97
2. J. Shepherd. Combined lipid lowering drug therapy for the
effective treatment of hypercholesterolaemia. European Heart
Journal 2003;24:685-689
3. Corsini A, et al. Fluvastatin: Clinical and Safety Profile.
Drugs 2004;64(12):1305-23
4. Scott M. Grundy et al., Implication of Recent Clinical trials
for the National Cholesterol Education Program ATIII Guidelines.
Circulation 2004;110:227-239
5. Mirko Di Martino, Alessandro Capone, Pierluigi Russo, Luca
Degli Esposti, Pierluigi Ceccarelli, Stefano Buda, Ezio Degli
Esposti, Luciano Caprino. La farmacoutilizzazione delle statine
nella pratica clinica: risultati di uno studio di popolazione
condotto su database amministrativi e di medici di medicina
generale. Farmeconomia e percorsi terapeutici 2003;1(suppl 1):15-23
6. Corsini A. Le statine dalla monoterapia alla terapia di combinazione.
Atti del Congresso Nazionale Interdisplinare “Siena Metabolismo
Duemilaquattro”, Siena, 16-17 Dicembre 2004
7. Corsini A et al. Studies on the biochemical defects underlying
the reduced response to simvastatin in hypercholesterolaemic
patients. Nutr Metab Cardiovasc Dis 1995;5:105-115
8. O’Neill F.H. et al. Determinants of variable response
to statin treatment with refractory familial hypercholesterolemia.
Arterioscler Thromb Vasc Biol 2001;21:832-837
9. Kesaniemi YA, Miettinen TA. Cholesterol absorption efficiency
regulates plasma cholesterol level in the Finnish population.
Eur J Clin Invest. 1987 Oct;17(5):391-5
10. Altmann SW, Davis Jr HR, Zhu LJ et al.. niemann Pick C1
Like 1 Protein in critical Intestinal Cholesterol Absorption.
Science 2004; Vol 303, 1201-1204
11. Prasad N.I. et al., Characterization of the putative native
and recombinant rat sterol transporter Niemann-Pick C1 Like
1 (NPC1L1) protein. Biochimica et Biophysica Acta, 1722: 282-292,
2005.
12. Davis H.R. et al., Niemann-Pick C1 Like 1 (NPC1L1) is the
intestinal phytosterol and cholesterol transporter and a key
modulator of whole-body cholesterol homeostasis. J. Biol. Chem.,
279 (32): 33586-33592, 2004
13. Garcia-Calvo M. et al. The target of ezetimibe is Niemann-Pick
C1-Like 1 (NPC1L1). PNAS, 102 (23): 8132-8137, 2005.
14. Corsini A. Un nuovo approccio al controllo del rischio cardiovascolare.
Ann Ital Med Int 2003;18 (Suppl 3):41S-48S
15. Sudhop T. et al. Inhibition of intestinal cholesterol absorption
by ezetimibe in humans.Circulation, 106: (15)- 1943-1948, 2002.
16. Mauro VF, Tuckerman CE. Ezetimibe for management of hypercholesterolemia.
Ann Pharmacother 2003 Jun 37 (6):839-48
17. Kosoglou T. et al. Ezetimibe. A review of its metabolism,
pharmacokinetics and drug interactions. Clin. Pharmacokinet.
44 (5): 467-194, 2005.
18. T.A. Miettinen and H. Gilling. Synthesis and absorption
markers of cholesterol in serum and lipoproteins during a large
dose of statin treatment. European Journal of Clinical Investigation
2003;33:976-982
19. A.C. Goldberg et al. Efficacy and safety of Ezetimibe coadmistratered
with simvastatin in patients with primary hypercholesterolemia:
a randomized, double-blind, placebo-controlled trial. Mayo Clin
Proc 2004;79:620-629
20. M.H. Davidson et al. Efficacy and safety ezetimibe coadministered
with statins : randomised, placebo-controlled, blinded experience
in 2382 patients with primary hypercholesterolemia. Int J Clin
Pract 2004;58 (8):746-755
21. C.M. Ballantyne et al. Long-term safety and tolerability
profile of ezetimibe and atorvastatin coadministration therapy
in patients with primary hypercholesterolaemia. Int J Clin Pract
2004;58 (7):653-658
22. Pearson T.A. et al. A community-based, randomized trial
of ezetimibe added to statin therapy to attain NCEP ATP III
Goals for LDL cholesterol in hypercholesterolemic patients:
the Ezetimibe Add-On to Statin for Effectiveness (EASE) Trial.
Mayo Clin Proc. 80 (5): 587-595, 2005.
23. Ballantyne C.M. et al., Efficacy and safety of ezetimibe
co-administered with simvastatin compared with atorvastatin
in adults with hypercholesterolemia. Am J Cardiol 93 : 1487-1494,
2004
24. T. Kosoglou et al. Effects of ezetimibe on the pharmacodynamics
and pharmacokinetics of lovastatin. Current Medical Research
and Opinion 2004; Vol 20 (6):955-965
25. T. Kosoglou et al. Pharmacodynamics interaction between
ezetimibe and rosuvastatin. Current Medical Research and Opinion
2004; Vol 20 (8):1185-1195
26. Farnier M et al, Efficacy and safety of codministration
of ezetimibe with fenofibrate in patients with mixed hyperlipidaemia.
Eur Heart J., in pres


