QUANDO,
COME E PERCHÉ ESEGUIRE UN ECOCARDIOGRAMMA TRANSESOFAGEO
P.
Caso, P. De Gregorio, S. Comenale Pinto, S. Severino,
D. Cardaropoli, R. Calabrò, N. Mininni
Diagnostica
non invasiva, Divisione di Cardiologia Cattedra di Cardiologia
II Università di Napoli,Dipartimento di Cardiologia,
Azienda Ospedaliera Monaldi
Introduzione
L’esame ecocardiografico transesofageo (ETE) è
stato proposto per primo da Frazin nel 19761. Tale esame è
nato dall’esigenza di superare i limiti dell’ecocardiografia
transtoracica (ETT) legati a fenomeni di aumentata impedenza
acustica quali: obesità, enfisema polmonare, deformazioni
toraciche, interposizione di materiale protesico o presenza
di ventilazione meccanica assistita. Inoltre, la metodica transesofagea,
per la stretta vicinanza dell’esofago alla superficie
posteriore del cuore, permette di visualizzare in modo ottimale
le strutture cardiache poste in profondità, quali atri,
auricole, setto interatriale, vene polmonari, valvole atrio-ventricolari
ed aorta toracica, in genere mal visualizzate dall’ETT.
Indicazioni
per l’ecocardiografia transesofagea
Molteplici sono le indicazioni cliniche per eseguire un ETE;
tra le più comuni ricordiamo la stratificazione del rischio
embolico in pazienti affetti da fibrillazione atriale prima
di sottoporli a cardioversione, la ricerca di possibili sorgenti
di emboli sistemici, lo studio delle valvulopatie la valutazione
dell’endocardite infettiva. Anche la cardiochirurgia si
avvale delle utili informazioni fornite dall’ETE soprattutto
nella valutazione della dissezione aortica, delle protesi valvolari
impiantate e nel monitoraggio intra e postoperatorio.
Cause
cardiache di embolismo
L’ETE è utile in caso di fibrillazione atriale
non valvolare valutando il rischio embolico mediante la visualizzazione
dell’ecocontrasto spontaneo e di trombi in atrio sinistro
e in auricola sinistra, la valutazione delle velocità
flussimetriche Doppler in auricola sinistra e la ricerca di
placche ateromasiche in aorta2,3. Infatti l’ETE in pazienti
con fibrillazione atriale prima della cardioversione ha dimostrato
la presenza di trombi in atrio ed auricola sinistra nel 5-15%
dei casi4.
Nello stroke criptogenetico giovanile riveste particolare interesse
la ricerca di forame ovale pervio per il possibile passaggio
di trombi da destra a sinistra attraverso il forame ovale durante
manovra di Valsalva o in caso di aumento di pressione a destra.
L’associazione tra forame ovale pervio ed aneurisma del
setto interatriale è correlato a maggior rischio di stroke.
Molti studi hanno dimostrato che l’ETE può definire
la presenza di forame ovale pervio sulla base del numero massimo
di microbolle visualizzabili in atrio sinistro in tre cicli
cardiaci, dopo aver iniettato mezzo di contrasto in atrio destro.
Il rischio embolico in pazienti con forame ovale pervio è
strettamente correlato al numero di microbolle, e questo consente
un migliore management terapeutico.
Endocarditi
Nei casi di sospetta endocardite, oltre al riconoscimento microbiologico,
l’ecocardiografia rappresenta l’indagine di prima
scelta per confermare il sospetto diagnostico. L’ecocardiografia
consente di visualizzare ed analizzare le vegetazioni sia su
valvole native che protesiche, e le principali complicanze.
Inoltre, essa può fornire indicazioni prognostiche e
terapeutiche medico-chirurgiche. Per le valvole native, la sensibilità
dell’ETE nei confronti di vegetazioni di dimensioni <
5 mm è di circa il 90% rispetto al 60% del ecocardiografia
transtoracica5,6,7. Questa metodica ha una sensibilità
maggiore anche in casi di sospetta endocardite su protesi valvolare
(85% versus 36% dell’ETT), al punto da essere considerata
l’indagine di primo livello8,9. Al pari della sensibilità,
anche la specificità dell’ETE è superiore
a quella dell’ETT, ciò riduce la probabilità
di falsi positivi dovuti alla presenza di tralci di fibrina
(strands) confusi per ispessimenti non specifici valvolari,
rottura e/o ridondanza di corde tendinee. Da non sottovalutare
il ruolo della metodica nelle studio delle complicanze dell’endocardite
quali formazioni ascessuali, fistole, pseudoaneurismi, perforazioni
valvolari, flail dei lembi o deiscenze delle protesi valvolari
che richiedono indicazione assoluta ad intervento chirurgico
precoce.
Protesi
valvolari
Le protesi valvolari si dividono in biologiche e meccaniche,
le prime sono ulteriormente divise in omologhe ed eterologhe,
le seconde si dividono in valvole a palla, monodisco e bidisco.
L’ETE è usato routinariamente per valutare le protesi
valvolari sia al momento dell’impianto sia per seguirne
la loro funzionalità nel tempo e l’eventuale insorgenza
di complicanze. In caso di disfunzione valvolare l’ETE
è utile nella diagnosi differenziale tra stenosi protesica
mitralica lieve e/o moderata, ed eventuali cause reversibili
di stenosi come trombosi protesiche, vegetazioni endocarditiche
ed anomalie strutturali delle protesi. Per quanto riguarda le
complicanze la metodica rende possibile l’identificazione
di fenomeni di tromboembolismo, trombosi e fibrosi sul lato
atriale della valvola in posizione mitralica, deiscenza valvolare,
endocardite coinvolgente l’anello valvolare e l’ascesso
perivalvolare10.
Monitoraggio
intraoperatorio
L’ETE in sede intraoperatoria è utile per valutare
lo stato di ipotensione, di ridotta gittata cardiaca e i problemi
relativi a valvolulopatie, soprattutto durante interventi di
sostituzione aortica e di plastica mitralica. Nello stato di
ipotensione inspiegata l’ETE può evidenziare possibili
cause rappresentate dalla disfunzione sistolica del ventricolo
sinistro o destro, dall’ipovolemia o dall’ostruzione
del tratto di efflusso. Inoltre, consente di formulare la diagnosi
di ipovolemia evidenziando una riduzione delle cavità
ventricolari associata ad una funzione sistolica ipercinetica,
fornendo utili informazioni sulla necessità di aumentare
l’introduzione di liquidi11. Nello studio intraoperatorio
di pazienti con sostituzione valvolare aortica l’ETE è
utile per valutare l’ipertrofia concentrica del ventricolo
sinistro che si sviluppa come meccanismo compensatorio. Particolare
interesse riveste lo studio della valvola mitrale durante interevento
di plastica valvolare. Infatti, l’ETE, consentendo un
accurato studio delle caratteristiche anatomiche e funzionali
della valvola e dell’apparato sottovalvolare, fornisce
al cardiochirurgo informazioni necessarie a programmare il tipo
di intervento per ottenere un buon successo operatorio12. L’ETE
è utile per escludere eventuali complicanze durante l’intervento
di valvuloplastica mitralica e il management post chirurgico,
quali insufficienza mitralica, spostamento del lembo anteriore
mitralico, deiscenza dell’anello, perforazione dei lembi,
stenosi mitralica, disfunzione regionale del ventricolo sinistro,
e disfunzione globale del ventricolo sinistro e/o destro.
Valvuloplastica
mitralica
La valutazione all’ETE del paziente con stenosi mitralica
canditato a valvuloplastica mitralica percutanea comprende lo
studio dell’atrio e dell’auricola sinistra per escludere
la presenza di trombi, e la quantizzazione dell’insufficienza
mitralica, che se di grado moderato (>2 +) controindica la
procedura. Inoltre, possono essere meglio indagate la mobilità,
le calcificazioni e l’ispessimento valvolare, oltre al
coinvolgimento dell’apparato sottovalvolare. I dati forniti
dall’esame consentono di predire il successo della valvuloplastica
a seconda dello score di Wilkins raggiunto; infatti, per un
punteggio <8 ci sono alte possibilità di ottenere
un buon risultato, cosa che non accade per uno score ==813.
Durante valvuloplastica mitralica, la tecnica è comunque
utile in casi selezionati per limitare l’esposizione a
radiazioni ionizzanti (donne in gravidanza).
Aorta
Malattia aterosclerotica dell’aorta L’ecocardiografia
rende difficile lo studio dell’aorta toracica, per cui
spesso si richiede un approfondimento diagnostico mediante ETE.
Una delle indicazioni è rappresenta dallo studio della
malattia ateromasica dell’aorta in pazienti con stroke
criptogenetico. Rispetto all’aortografia, alla TC e alla
RMN, l’ETE ha una migliore risoluzione delle immagini
ed è in real-time. Essa consente di visualizzare le placche
aterosclerotiche, di studiarne la morfologia, la mobilità
e l’effetto emodinamico. Un maggiore rischio di stroke
è correlato non solo alle dimensioni delle placche (>4-5
mm), ma soprattutto alla loro mobilità, all’evidenza
di ulcerazioni ed alla protusione nel lume aortico14-18.
Una delle classificazioni della malattia ateromasica aortica
individua 5 gradi corrispondenti rispettivamente: 1) minimo
ispessimento intimale, 2) ispessimento intimale esteso, 3) ateroma
sessile < 4 mm, 4) ateroma protudente = 4 mm e 5) ateroma
mobile o ulcerato. Gli ultimi due tipi di lesione sono associati
ad un rischio quattro volte maggiore di embolizzazioni periferiche
rispetto al primo tipo10. Altra condizione in cui può
essere dirimente l’apporto diagnostico dell’ETE
è rappresentata dall’ulcera penetrante dell’aorta
a seguito di un’ulcerazione di una placca aterosclerotica
che eroda la lamina elastica fino alla media dell’aorta.
Le complicanze cui frequentemente si va incontro in questa situazione
sono rappresentate dalla rottura aortica transmurale, dall’ematoma
intramurale, dallo pseudoaneurisma dell’aorta toracica
o dalla vera e propria dissezione. Il tratto maggiormente interessato
è l’aorta discendente, maggiormente colpito da
fenomeni di aterosclerosi. La sintomatologia che accompagna
questa patologia è caratterizzata da dolore toracico
improvviso19,20.
Dissezione
aortica Altra condizione in cui l’ETE trova ampia indicazione
è la dissezione aortica, dal momento che rispetto ad
indagini quale la TC e la RMN l’ETE è un esame
dalla rapida esecuzione, anche in unità di emergenza
e/o terapia intensiva, dai bassi costi e consente non solo lo
studio dell’aorta ma contemporaneamente anche del cuore
e dei vasi che nascono dall’aorta, con la possibilità
di individuare rapidamente le complicanze legate a questa patologia.
La caratteristica anatomopatolgica tipica della dissezione aortica
è il flap intimale, che si evidenzia in oltre il 90%
dei casi, che appare ecocardiograficamente come un’eco
lineare all’interno del lume aortico, così suddiviso
in un vero lume ed uno falso, distinguibili per le differenze
che si registrano sia al color Doppler (evidenza di flusso)
che in scala di grigi (contrasto spontaneo). Le classificazione
della dissezione aortica più seguite sono quella di DeBakey
e quella di Stanford, entrambe basate sulla localizzazione del
flap intimale. La prima distingue tre tipi: il tipo I e II,
nei quali l’origine del flap è localizzata in aorta
ascendente, il I con estensione fino all’arco, il II confinato
all’aorta ascendente, ed il tipo III con origine del flap
in aorta discendente ed estensione distale. Secondo la classificazione
di Stanford, distinguiamo il tipo A, che coinvolge l’aorta
ascendente indipendentemente dalla localizzazione del flap,
che richiede un intervento in emergenza, ed il tipo B con origine
del flap oltre l’origine dell’arteria succlavia
sinistra, che può essere trattata anche farmacologicamente19,20.
Cardiopatie
congenite
Un’indicazione importante è la valutazione di cardiopatie
congenite sia in età pediatrica sia in età adulta
in quanto spesso la finestra transtoracica è inadeguata
ad una definizione diagnostica. Le principali indicazioni sono
lo studio del setto interatriale per la chiusura di difetti
interatriali con procedura interventistica mediante impianto
di device ad ombrello, la ricerca di ritorni venosi anomali
polmonari, la persistenza della vena cava superiore sinistra
e le complicanze postoperatorie (distacco di patch, shunt in
Fontan, stenosi in Mustard).
Preparazione
del paziente
La preparazione del paziente prevede almeno quattro ore di digiuno
prima della procedura e successivamente consiste nel fornire
un’adeguata informazione sulla procedura e sui rischi
ad essa legati, al fine di ottenerne il consenso informato.
L’anamnesi deve essere rivolta sia ad indagare sulle indicazioni
dell’esame sia soprattutto individuare possibili controindicazioni
all’esecuzione dell’esame; tra queste attenzione
particolare va rivolta a patologie del tratto gastroenterico,
tra cui cause che ostacolano in passaggio della sonda in esofago,
diverticolo esofagei, sanguinamento gastro-intestinale. Bisogna
indagare su eventuali terapie intraprese dal paziente, in particolare
terapie anticoagulanti, al fine di modificare la terapia per
ridurre al minimo il rischio di sanguinamento, uso di sedativi
e/o tranquillanti, che potrebbero fare interferenza con i farmaci
usati nella sedezione del paziente durante l’esame. Importante
prima di iniziare la procedura è dotare il paziente di
un accesso venoso, sia per la somministrazione di farmaci per
la sedazione sia per l’eventuale somministrazione di mezzo
di contrasto (soluzione salina agitata) in particolari indicazioni
(forame ovale pervio, difetto interatriale).
Intubazione
esofagea
Prima dell’introduzione della sonda bisogna rimuovere
eventuali protesi dentarie e/o orali. In alcuni casi può
essere utile somministrare ossigeno attraverso una cannula nasale.
Si può ricorrere ad un’anestesia locale con farmaci
quali la benzocaina o la lidocaina. Per la sedazione del paziente
si preferisce utilizzare il midazolam. Nei casi più difficili
si può ricorrere alla consulenza di un anestesista che
fornisca assistenza per la sedazione e l’introduzione
della sonda. L’ispezione della sonda è importante
prima dell’introduzione al fine di verificarne l’integrità.
Altra manovra da effettuare è l’ispezione del cavo
orale. Successivamente il paziente deve assumere la posizione
in decubito laterale sinistro flettendo leggermente il capo
(collo) in avanti, al fine di facilitare il passaggio della
sonda. La sonda deve essere introdotta con una leggera flessione
anteriore. L’introduzione deve avvenire gradualmente,
senza forzare in caso di resistenza. Una volta in esofago la
maggior parte dei pazienti tollera discretamente la procedura,
consentendo il completamento dell’esame.
BIBLIOGRAFIA
1.
Frazin L, Talano JV, Stephanides L, et al. Esophageal echocardiography.
Circulation 1976; 54: 102-108
2. The Stroke Prevention in Atrial Fibrillation Investigators.
Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic
features of patients at risk. Ann Intern Med 1992; 116:6–12
3. The Stroke Prevention in Atrial Fibrillation Investigators
Committee. Transesophageal echocardiographic correlates of thromboembolism
in high-risk patients with nonvalvular atrial fibrillation.
Ann Intern Med 1998; 128:639–647
4. Mugge A, Daniel WG, Hausman D, et al. Diagnosis of left atrial
appendage thrombi by transesophageal echocardiography: clinical
implications and follow-up. Am J Card Imaging 1990; 4:173–179
5. Shively BK, Gurule FT, Roldan CA, et al. Diagnostic value
of transesophageal compared with transthoracic echocardiography
in infective endocarditis. J Am Coll Cardiol 1991; 18:391–
397.
6. Flachskampf FA, Daniel WG. Role of transesophageal echocardiography
in infective endocarditis. Heart 2000; 84:3–4
7. Erbel R, Rohmann S, Drexler M, et al. Improved diagnostic
value of echocardiography in patients with infective endocarditis
by transesophageal approach: a prospective study. Eur Heart
J 1988; 9:43–53
8. Pedersen WR, Walker M, Olson JD, et al. Value of transesophageal
echocardiography as an adjunct to transthoracic echocardiography
in evaluation of native and prosthetic valve endocarditis. Chest
1991; 100:351–356
9. Daniel WG, Mugge A, Grote J, et al. Comparison of transthoracic
and transesophageal echocardiography for detection of abnormalities
of prosthetic and bioprosthetic valves in the mitral and aortic
positions. Am J Cardiol 1993; 71:210–215
10. Milani RV, Lavie CJ, Gilliland YE, Cassidy MM, Bernal JA.
Overview of transesophageal echocardiography for the chest physician.
Chest 2003; 124:1081-1089
11. Shanewise JS, Cheung AT, Aronson S, et al. ASE/SCA guidelines
for performing a comprehensive intraoperative multiplane transesophageal
echocardiography examination: recommendations of the American
Society of Echocardiography Council for Intraoperative Echocardiography
and the Society of Cardiovascular Anesthesiologists Task Force
for Certification in Perioperative Transesophageal Echocardiography.
J Am Soc Echocardiogr 1999; 12:884–900
12. Fehske W, Grayburn PA, Omran H, et al. Morphology of the
mitral valve as displayed by multiplane transesophageal echocardiography.
J Am Soc Echocardiogr 1994; 7:472–479
13. Abascal VM, Wilkins GT, O’Shea JP, et al. Prediction
of successful outcome in 130 patients undergoing percutaneous
balloon mitral valvotomy. Circulation 1990; 82:448–456
14. Tunick PA, Kronzon I. Protruding atheromas in the thoracic
aorta: a newly recognized source of cerebral and systemic embolization.
Echocardiography 1993; 10:491–495
15. Kronzon I, Tunick PA. Atheromatous disease of the thoracic
aorta: pathologic and clinical implications. Ann Intern Med
1997; 126:629–637
16. Lopez-Candales A. Assessing the aorta with transesophageal
echocardiography: update on imaging capabilities with today’s
technology. Postgrad Med 1999; 106:157–172
17. Ferrari E, Vidal R, Chevallier T, et al. Atherosclerosis
of the thoracic aorta and aortic debris as a marker of poor
prognosis: benefits of oral anticoagulants. J Am Coll Cardiol
1999; 33:1317–1322
18. Davila-Roman VG, Murphy SF, Nickerson NJ, et al. Atherosclerosis
of the ascending aorta is an independent predictor of long-term
neurologic events and mortality. J Am Coll Cardiol 1999; 33:1308–1316
19. Willens HJ, Kessler KM. Transesophageal echocardiography
in the diagnosis of diseases of the thoracic aorta: Part I.
Aortic dissection, aortic intramural hematoma, and penetrating
atherosclerotic ulcer of the aorta. Chest 1999; 116:1772–1779
20. Pepi M, Campodonico J, Galli C, et al. Rapid diagnosis and
management of thoracic aortic dissection and intramural hematoma:
a prospective study of advantages of multiplane vs biplane transesophageal
echocardiography. Eur J Echocardiogr 2000; 1:72–79
Immagini
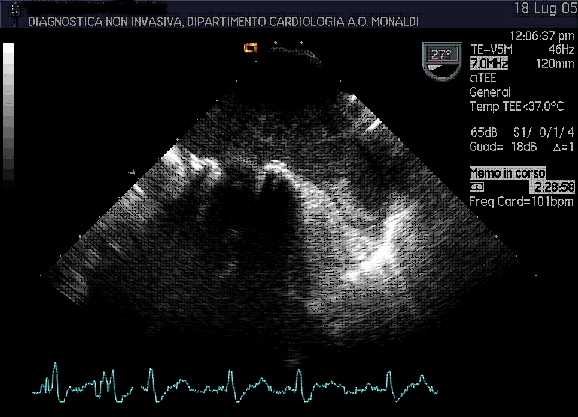
Trombo in auricola sinistra.
Ecocardiografia transeofagea, posizione esofago medio, sonda
multiplana a 27°, con visualizzazione di atrio, ventricolo
ed auricola sinistra. Si evidenzia protesi meccanica in sede
mitralica. L’atrio sinistro appare dilatato e con marcati
fenomeni di econtrasto spontaneo dovuti al rallentamento del
flusso in atrio sinistro. Si evidenzia trombo stratificato in
auricola sinistra

